1、填空题 晶胞都是从晶体结构中截取下来的大小、形状完全相同的________,将一?个个晶胞上、下、前、后、左、右并置起来,就构成__________。
参考答案:平行六面体;整个晶体结构
本题解析:
本题难度:一般
2、选择题 处于固体状态的下列物质,其晶体类型正确的一组是?(? )?
?
| 离子晶体
| 分子晶体
| 原子晶体
|
A.
| KOH
| SO3
| Ar
|
B.
| H2SO4
| 硫磺
| 石墨
|
C.
| CH3COONH4
| H2O
| 水晶
|
D.
| Ba(OH)2
| 玻璃
| 金刚石
参考答案:C
本题解析:离子间通过离子键形成的晶体是离子晶体,分子间通过分子间作用力形成的晶体是分子晶体,
原子间通过共价键形成的空间网状结构的晶体是原子晶体,据此可知,C正确。A中Ar是分子晶体,B
中硫酸是分子晶体,石墨是混合型的,D中玻璃是
混合物,不是分子晶体,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,侧重对学生基础性知识的巩固
与训练。该题的关键是记住几种晶体的概念以及判断标准,然后灵活运用即可。
本题难度:一般
3、简答题 下列是部分金属元素的电离能
| X | Y | Z
第一电离能(kJ/mol)
520.2
495.8
418.8
|
(1)已知X、Y、Z的价层电子构型为ns1,则三种金属的氯化物(RCl)的熔点由低到高的顺序为______.
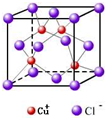
(2)CuCl用作有机合成催化剂,并用于颜料,防腐等工业.CuCl的晶体结构如图所示.元素Cu基态原子的电子排布式______,与同一个Cl-相连的Cu+有______个.
参考答案:(1)X、Y、Z的价层电子构型为ns1,则这三种元素都属于第IA族元素,同一主族元素,元素的第一电离能随着原子序数的增大而减小,根据表格知,X、Y、Z这三种元素的金属性逐渐增强,原子半径逐渐增大,这三种金属的氯化物(RCl)都是离子晶体,离子晶体的熔点与离子半径成反比,与电荷数成正比,X、Y、Z这三种阳离子电荷数相等,离子半径逐渐增大,所以其熔点从小到大的顺序是ZCl<YCl<XCl,故答案为:ZCl<YCl<XCl;
(2)铜是29号元素,其原子核外有29个电子,根据构造原理知其基态原子核外电子排布式为:[Ar]3d104s1,根据晶胞结构知,面心上的氯离子连接4个亚铜离子,
故答案为:[Ar]3d104s1,4.
本题解析:
本题难度:简单
4、选择题 关于下列几种离子晶体,说法不正确的是(?)
A.由于NaCl 晶体和CsCl晶体中正负离子半径比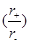 不相等,所以两晶体中离子的配位数不相等 不相等,所以两晶体中离子的配位数不相等
B.CaF2晶体中,Ca2+配位数为8,F-配位数为4不相等,主要是由于F-、Ca2+电荷(绝对值)不相同
C.MgO的熔点比MgCl2高主要是因为MgO的晶体能比MgCl2大
D.MCO3中M2+半径越大,MCO3热分解温度越低
参考答案:D
本题解析:A、正确,氯化钠配位数为6,氯化铯的配位数为8;
B、是由于电荷不相同引起的,正确。
C、离子晶体,电荷越多,半径越小,晶格能越大;
D、熔沸点与分解温度不是一回事。错误
本题难度:一般
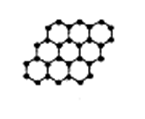
5、选择题 石墨烯是由碳原子构成的单层片状结构的新材料(结构示意图如图),可由石墨剥离而成,具有极好的应用前景。下列说法正确的是
A.石墨烯与石墨互为同位素
B.0.12g石墨烯中含6.02×l022个碳原子
C.石墨烯是一种化合物
D.在整个单层片结构中属于每个六边形的碳原子数实际为2个
参考答案:D
本题解析:石墨烯与石墨均为碳的不同单质,属同素异形体,排除AC;0.12g石墨烯的物质的量为0.01mol,其中含碳原子0.01NA即6.02×l021个,排除B;由石墨烯的结构可看出,每个碳原子被三个碳环所共同占有,也就是说每个环只占有一个碳原子的1/3,所以一个六元环占6×1/3=2个碳原子。
故答案为D
本题难度:简单
|