1、选择题 已知:H+(aq)+OH-(aq) =H2O(l); △H=-57.3 kJ·mol-1。现将一定量的稀盐酸、浓硫酸、稀醋酸分别和1L 1mol·L-1的NaOH溶液恰好完全反应,其反应热分别为△H1、△H2、△H3,,则△H1、△H2和△H3的大小关系为
A.△H1=△H2
B.△H2>△H1
C.△H3>△H2
D.△H1>△H3
参考答案:C
本题解析:H+(aq)+OH-(aq)═H2O(l);△H=-57.3kJ?mol-1;中和热是强酸强碱稀溶液完全反应生成1mol水放出的热量,一定量的稀盐酸和1L?1mol?L-1的NaOH溶液恰好完全反应放热57.3kJ;浓硫酸和1L?1mol?L-1的NaOH溶液恰好完全反应,溶解过程中放热,反应放热大于57.3kJ,醋酸是弱电解质存在电离平衡,电离过程是吸热程,醋酸和1L?1mol?L-1的NaOH溶液恰好完全反应放热小于57.3kJ;反应焓变是负值,所以△H3>△H1>△H2;故选C。
本题难度:一般
2、填空题 氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答下列问题:
(1)右图是1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式?。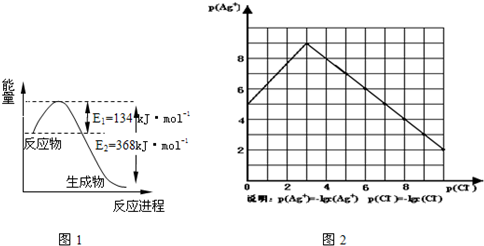
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)  2NH3(g)△H<0其化学平衡常数K与温度t的关系如右表:请完成下列问题;
2NH3(g)△H<0其化学平衡常数K与温度t的关系如右表:请完成下列问题;
?
①试比较K1、K2的大小,K1____K2(填写“>”、“=”或“<”)
②下列各项能作为判断该反应达到化学平衡状态的依据是____一(填序号字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2
b.v(N2)正=3v(H2)逆
c.容器内压强保持不变
d.混合气体的密度保持不变
③400℃时,反应2NH3(g)  N2(g)+3H2(g)的化学平衡常数的值为?。当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的v(N2)正 __? v(N2)逆(填写“>”、“=”或“<”=)
N2(g)+3H2(g)的化学平衡常数的值为?。当测得NH3和N2、H2的物质的量分别为3mol和2mol、1mol时,则该反应的v(N2)正 __? v(N2)逆(填写“>”、“=”或“<”=)
参考答案:(1)NO2(g)+CO(g) CO2(g)+NO(g);△H=-234kJ/mol?(2) ① >?②? c?③? 2? >
CO2(g)+NO(g);△H=-234kJ/mol?(2) ① >?②? c?③? 2? >
本题解析:(1)由图可知:NO2和CO反应的热化学方程式为:NO2(g)+CO(g) CO2(g)+NO(g);△H=-234kJ/mol 。(2) ①升高温度化学平衡向吸热反应方向移动。由于该反应的正反应是放热反应。所以升高温度化学平衡向逆反应方向移动。平衡越向逆反应方向移动,反应的平衡常数就越小。所以K1 >K2。②a平衡时各物质的浓度与起始加入的物质的多少有关。只要平衡时各种物质的浓度不变,反应就达到了平衡。错误。b.在任何时刻都有3v(N2)正=v(H2)正,而v(N2)正=3v(H2)逆,代入第一个式子可得9 v(H2)逆= v(H2)正。由于V(H2)正>V(H2)逆。反应未达到平衡。错误。c.由于容器的容积不变,若反应达到平衡,各种物质的物质的量不变,容器内压强也保持不变 。正确。? d.反应无论进行到什么程度,质量都不会发生变化,那么任何时刻混合气体的密度都保持不变。所以不能根据容器的容积不变来判断反应达到平衡。错误。选项为:C. ③400℃时,2NH3(g)
CO2(g)+NO(g);△H=-234kJ/mol 。(2) ①升高温度化学平衡向吸热反应方向移动。由于该反应的正反应是放热反应。所以升高温度化学平衡向逆反应方向移动。平衡越向逆反应方向移动,反应的平衡常数就越小。所以K1 >K2。②a平衡时各物质的浓度与起始加入的物质的多少有关。只要平衡时各种物质的浓度不变,反应就达到了平衡。错误。b.在任何时刻都有3v(N2)正=v(H2)正,而v(N2)正=3v(H2)逆,代入第一个式子可得9 v(H2)逆= v(H2)正。由于V(H2)正>V(H2)逆。反应未达到平衡。错误。c.由于容器的容积不变,若反应达到平衡,各种物质的物质的量不变,容器内压强也保持不变 。正确。? d.反应无论进行到什么程度,质量都不会发生变化,那么任何时刻混合气体的密度都保持不变。所以不能根据容器的容积不变来判断反应达到平衡。错误。选项为:C. ③400℃时,2NH3(g)  N2(g)+3H2(g)的化学平衡常数和反应N2(g)+3H2(g)
N2(g)+3H2(g)的化学平衡常数和反应N2(g)+3H2(g)  2NH3(g)的化学平衡常数互为倒数。即为2,。由于C2(NH3)/C(N2)C3(H2)=62/(4×23)=9/8<2.所以反应向正反应方向移动。即V(N2)正> V(N2)逆。
2NH3(g)的化学平衡常数互为倒数。即为2,。由于C2(NH3)/C(N2)C3(H2)=62/(4×23)=9/8<2.所以反应向正反应方向移动。即V(N2)正> V(N2)逆。
本题难度:一般
3、选择题 下列说法中,不正确的是
A.化学反应中既有物质变化又有能量变化
B.即使没有发生化学变化,也可能有能量的变化
C.任何化学反应中的能量变化都表现为热量变化
D.物质的化学能可以通过不同的变化方式转化为热能、电能等
参考答案:C
本题解析:化学反应中既有物质变化又有能量变化,故A正确;即使没有发生化学变化,也可能有能量的变化,例如水的蒸发,故B正确;化学反应中的能量变化一般表现为热量变化,也可以伴随着光能等的变化,所以C错误;物质的化学能可以通过不同的变化方式转化为热能、电能等,故D正确。所以答案为C。
点评:本题考查了化学的相关术语,是高考考查的重点,该题不难。
本题难度:简单
4、选择题 下列实验事实所引出的相应结论正确的是
选项
| 实验事实
| 结论
|
A
| Na2S2O3溶液与稀H2SO4溶液混合时,其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短
| 当其他条件不变时,增大反应物浓度化学反应速率加快
|
B
| 在化学反应前后,催化剂的质量和化学性质都没有发生改变
| 催化剂一定不参加化学反应
|
C
| 将NH4Cl晶体与Ba(OH)2.8H2O晶体混合后研磨,烧杯壁温度降低
| 该反应为吸热反应
|
D
| 在容积可变的密闭容器中发生反应
H2(g)+ I2(g) 2HI(g), 2HI(g),
把容积缩小一倍
| 正反应速率加快,逆反应速率不变
参考答案:AC
本题解析:
正确答案AC
A、当其他条件不变时,增大反应物浓度化学反应速率加快。
B、在化学反应前后,催化剂的质量和化学性质都没有发生改变,但物理性质改变,催化剂可能参加反应。
C、NH4Cl晶体与Ba(OH)2.8H2O晶体为吸热反应。
D、H2(g)+ I2(g)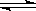 2HI(g),把容积缩小一倍,浓度均增大,正逆反应速率均加快,只是变化的幅度相同,所以平衡不移动。 2HI(g),把容积缩小一倍,浓度均增大,正逆反应速率均加快,只是变化的幅度相同,所以平衡不移动。
本题难度:一般
5、选择题 .强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq) +OH-(aq)═H2O(l)
△H = -57.3kJ/mol。分别向1L 0.5mol/L的Ba(OH)2的溶液中加入①浓硫酸;② 稀硫酸;③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是
A.△H1<△H2=△H3
B.△H1>△H2>△H3
C.△H1>△H2=△H3
D.△H1=△H2<△H3
参考答案:A
本题解析:浓硫酸有强烈的吸水性,溶解于水放出大量的热,所以△H1<△H; 稀硫酸、稀硝酸都电离产生大量的氢离子,在溶液中发生反应H+(aq) +OH-(aq)═H2O(l),放出热量△H2=△H3=△H。所以正确选项为A。
本题难度:一般
|