1、选择题 如图所示的装置,通电一段时间后,测得甲池中某电极质量增加2.16 g,乙池中某电极上析出0.64 g某金属,下列说法正确的是

A.甲池b极上析出金属银,乙池c极上析出某金属
B.甲池a极上析出金属银,乙池d极上析出某金属
C.某盐溶液可能是CuSO4溶液
D.某盐溶液可能是Mg(NO3)2溶液
2、填空题 (11分)H2O2是一种常用绿色氧化剂,在化学研究中应用广泛。
(1)请写出H2O2的电子式 。
(2)H2O2分解过程的能量变化如图(a)所示,
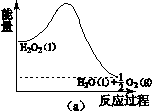
试判断该反应为 反应(吸热或放热)。
①已知:Fe3+催化H2O2分解的机理可分两步反应进行,
第一步反应为:2Fe3++H2O2=2Fe2++O2↑+2H+,
完成第二步反应的离子方程式:
 Fe2++
Fe2++  H2O2 +
H2O2 +  _________ ="="
_________ ="="  _________+
_________+  _________
_________
②按图(b)装置(A、B瓶中已充有NO2气体,2NO2(g)  N2O4(g), ΔH<0)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),原因是 。
N2O4(g), ΔH<0)进行实验。可观察到B瓶中气体颜色比A瓶中的 (填“深”或“浅”),原因是 。

(3)空气阴极法电解制备H2O2的装置如图(c)所示,主要原理是在碱性电解质溶液中,利用空气中O2在阴极反应得到H2O2和稀碱的混合物。
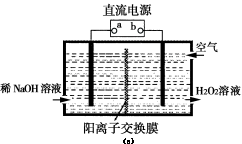
试回答:
①电源a极的名称是 。
②写出阴极电极反应式 。
(4)用H2O2和H2SO4的混合溶液可溶解印刷电路板中的金属铜,请写出铜溶解的离子方程式 ,控制其它条件相同,印刷电路板的金属粉末用10% H2O2和3.0 mol·L-1 H2SO4溶液处理,测得不同温度下铜的平均溶解速率(见下表)。
温度(℃)
| 20
| 30
| 40
| 50
| 60
| 70
| 80
|
Cu的平均溶解速率
(×10-3mol·min-1)
| 7.34
| 8.01
| 9.25
| 7.98
| 7.24
| 6.73
| 5.76
|
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是 。
3、选择题 乙醛酸(OHCCOOH)是合成名贵高档香料乙基香兰素 的原料之一,可用草酸(HOOCCOOH)电解制备,装置如图所示。下列说法不正确的是(?)
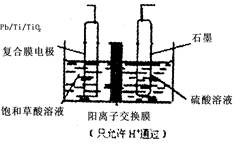
A.电解时石墨电极应与直流电的正极相连
B.阴极反应式为:HOOCCOOH+2H++2e-=OHCCOOH+H2O
C.电解时石墨电极上有O2放出
D.电解一段时间后,硫酸溶液的pH不变化
4、计算题 铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(
5、填空题 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”。工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2。
(1)亚氯酸钠也是一种性能优良的漂白剂,但在强酸性溶液中会发生歧化反应,产生ClO2气体,离子方程式为 。向亚氯酸钠溶液中加入盐酸,反应剧烈。若将盐酸改为相同pH的硫酸,开始时反应缓慢,稍后一段时间产生气体速率迅速加快。产生气体速率迅速加快的原因是 。
(2)化学法可采用盐酸或双氧水还原氯酸钠制备ClO2。用H2O2作还原剂制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
(3)电解法是目前研究最为热门的生产ClO2的方法之一。如图所示为直接电解氯酸钠、自动催化循环制备高纯ClO2的实验。

①电源负极为 极(填A或B):
②写出阴极室发生反应依次为: 、
;
③控制电解液H+不低于5mol/L,可有效防止因H+浓度降低而导致的ClO2