1、填空题 工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)路布兰法是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取、结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为____________________;
②硫酸钠和焦炭、石灰石反应的化学方程式为_______________ (已知产物之一为CaS);
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
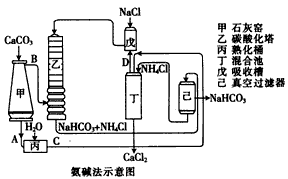
①图中的中间产物C是__________,D是________(写化学式);
②装置乙中发生反应的化学方程式为_____________________;
(3)联合制碱法是对氨碱法的改进,其优点是___________________;
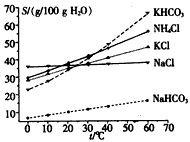
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石等为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?________________________
参考答案:
(1)①2NaCl+H2SO4(浓) Na2SO4+2HCl;②Na2SO4+4C+CaCO3
Na2SO4+2HCl;②Na2SO4+4C+CaCO3 CaS+Na2CO3+4CO
CaS+Na2CO3+4CO
(2)①Ca(OH)2;NH3;②NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl
(3)保留了氨碱法的优点,使食盐的利用率提高到96%,NH4Cl可做氮肥,可与合成氨厂联合,原料气氨气和一氧化碳都由氨厂提供,减少CaCO3制CO2这一工序,降低了能耗与污染。
(4)不可行,因为在纯碱的生产中,生成的碳酸氢钠溶解度小于氯化钠,故生产中能以晶体析出而分离。但若用于碳酸钾的生产,将会生成碳酸氢钾,其溶解度要远小于氯化钠,必须在温度接近0℃时才能结晶,能耗过大,工业上不可行。
本题解析:
本题难度:一般
2、填空题 纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制碱法”两种工艺。请按要求回答问题:
(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:_______________
(2)写出“联合制碱法”有关反应的化学方程式:_____________________
(3)CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?_________________________
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:原子利用率(%)=_________________
参考答案:(1)2NH4Cl+2Ca(OH)2 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
(2)NH3+CO2+H2O+NaCl(饱和)==NaHCO3↓+NH4Cl、2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(或2NaCl+2NH3+CO2+H2O==Na2CO3+2NH4Cl)
(3)“氨碱法”中的CO2来源于石灰石煅烧,“联合制碱法”中的CO2来源于合成氨丁业的废气
(4)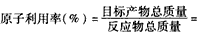
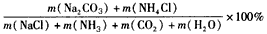
本题解析:
本题难度:一般
3、简答题 我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献.他以NaCl、NH3、CO2等为原料先制得NaHCO3,进而生产出纯碱.有关反应的化学方程式为:
NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3?
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是______
a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.
①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).
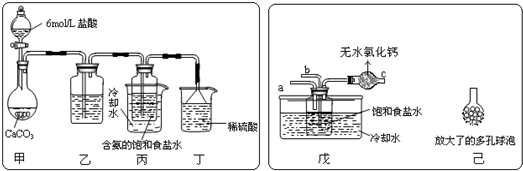
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是______;
(Ⅱ)丁装置中稀硫酸的作用是______;
(Ⅲ)实验结束后,分离出NaHCO3?晶体的操作是______(填分离操作的名称).
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从______管通入______?气体,再从______管中通入______气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是______;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法:______.
参考答案:(1)a.碳酸氢钠易溶于水,故A错误;
b.碳酸氢钠受热易分解,与其在溶液中首先结晶析出无关,故B错误;
c.碳酸氢钠的溶解度相对于氯化铵来说碳酸氢钠的溶解度更小一些,所以在溶液中首先结晶析出,故C正确;
故选C;
(2)①(I)利用盐酸制取二氧化碳时,因盐酸易挥发,所以,二氧化碳中常会含有氯化氢气体,碳酸氢钠能与盐酸反应不与二氧化碳反应,所以通过碳酸氢钠的溶液是可以除掉二氧化碳气体中的氯化氢气体,故答案为:饱和碳酸氢钠溶液;
(II)实验过程中氨气可能有剩余,而稀硫酸能与氨气反应,所以稀硫酸的作用是吸收末反应的NH3,故答案为:吸收未反应的NH3;
(III)分离出NaHCO3晶体的操作是分离固体与液体,常采用的实验操作是过滤操作,故答案为:过滤;
②(I)制取碳酸氢钠时先要得到含氨的饱和食盐水,氨气极易溶于水,二氧化碳能溶于水,所以应先通入氨气,所以a端通入,从而保证了从b通入二氧化碳时,二氧化碳被充分反应;故答案为:a、NH3,b、CO2;
(II)装置改动后反应物的二氧化碳与溶液的接触面积变大,提高了二氧化碳的吸收率,故答案为:增大气体与溶液接触面积,提高CO2吸收率;
(3)从题干信息NH4HCO3+NaCl═NaHCO3↓+NH4Cl;可得制取碳酸氢钠的方法,同时也可采用烧碱溶液中通入过量CO2或往饱和Na2CO3 溶液中通入过量CO2 等得到碳酸氢钠,
故答案为:用碳酸氢铵与适量饱和食盐水反应,或往烧碱溶液中通入过量CO2;或往饱和Na2CO3?溶液中通入过量CO2?等;
本题解析:
本题难度:一般
4、简答题 我国制碱工业的先驱侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:
NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3(晶体)
依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和.
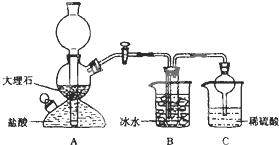
(1)A装置中所发生反应的离子方程式为______.
C装置中稀硫酸的作用为______.
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 温度溶解度 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
NaHCO3
6.9
8.1
9.6
11.1
12.7
14.5
NH4Cl
29.4
33.3
37.2
41.4
45.8
50.4
|
参照表中数据,请分析B装置中使用冰水的目的是______.
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在______装置之间(填写字母)连接一个盛有______的洗气装置,其作用是______.
参考答案:(1)A装置是指取二氧化碳气体的装置,是碳酸钙和盐酸发生反应生成氯化钙、水和二氧化碳;反应的离子方程式为:CaCO3+2H+═Ca2++CO2↑+H2O;C装置稀硫酸是尾气处理装置吸收过量的氨气,防止污染环境,
故答案为:CaCO3+2H+═Ca2++CO2↑+H2O;吸收从B装置中的试管内逸出的氨气,减少对环境的污染;
(2)B装置中的试管内是溶有氨和氯化钠的饱和溶液,通入二氧化碳气体会发生反应生成碳酸氢钠和氯化铵,依据图标分析可知温度越低,碳酸氢钠的溶解度越小,所以温度越低越有利于碳酸氢钠的晶体析出,
故答案为:温度越低,碳酸氢钠的溶解度越小,便于析出;
(3)二氧化碳气体中含有氯化氢气体,通入后和氨气反应不能生成碳酸氢钠,所以的不到碳酸氢钠晶体,所以需要加一个洗气装置用饱和碳酸氢钠溶液除去二氧化碳中的氯化氢气体,
故答案为:A与B;饱和NaHCO3溶液;除去CO2中混合的HCl气体.
本题解析:
本题难度:一般
5、填空题 以食盐为原料进行生产并综合利用的某些过程如下图所示。

(1)除去粗盐中的Ca2+、Mg2+和SO42-,加入下列沉淀剂的顺序是(填序号)________。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是___________。
(3)电解饱和食盐水反应的离子方程式是________________。
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是____________。
(5)纯碱在生产生活中有广泛的应用。
①纯碱可用于除灶台油污。其原因是(结合离子方程式表述)_______________。
②常温下,向某pH= 11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13。则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是__________
③工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是___________________。(已知碳酸的酸性强于次氯酸)
参考答案:(l)cab或者cba或者bca
(2)CO32-、OH-
(3)2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
(4)NH3
(5)①CO32-水解显碱性CO32-+H2O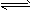 HCO3-+OH-,油污在碱性条件下水解,达到去污目的;
HCO3-+OH-,油污在碱性条件下水解,达到去污目的;
②1×1010;③2CO32-+Cl2+H2O==Cl-+ClO-+2HCO3-
本题解析:
本题难度:一般