1、选择题 设阿伏加德罗常数为NA,则下列说法正确的是(?)
A 氧气的摩尔质量为32克
B 标准状况下,0.3molSO2中含氧原子数为0.3NA
C 常温下,2.7克Al3+所带的电荷数为0.3 NA
D 常温下,9.5克MgCl2晶体中含Mg2+为0.2 NA
参考答案:C
本题解析:考查阿伏加德罗常数的相关知识
A、摩尔质量的单位错误:g/mol,排除
B、0.3molSO2中含氧原子数为0.6NA,不正确
C、2.7克Al3+所带的电荷数为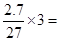 0.3 NA,正确
0.3 NA,正确
D、9.5克MgCl2晶体中含Mg2+为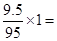 0.1NA,不正确
0.1NA,不正确
答案为C
本题难度:简单
2、选择题 在标准状况下,mg气体A与ng气体B的分子数相同,下列说法不正确的是(?)。
A.气体A与B的相对分子质量之比是m∶n
B.相同质量的气体A与B的分子数之比是n∶m
C.同温同压下气体A与B的密度之比为n∶m
D.相同状况下,同体积气体A与B的质量比为m∶n
参考答案:C
本题解析:mg气体A与ng气体B的分子数相同,则A与B的摩尔质量之比是n∶m,选项A不正确;相同质量的气体A与B的分子数之比是m∶n,选项B不正确;同温同压下气体的密度之比是相应的摩尔质量之比,所以选项C正确;相同状况下,同体积气体A与B的质量比为n∶m,选项D不正确,因此正确的答案选C。
本题难度:一般
3、选择题 如果1 g水中含有n个氢原子,则阿伏加德罗常数是:
A.n/1mol-1
B.9n mol-1
C.2nmol-1
D.nmol-1
参考答案:B
本题解析:水的化学式为H2O,其中含有2个氢原子,18g克水为1mol,其中含有的氢原子数为18n,所以阿伏加德罗常数是18n/2=9n,答案选B。
点评:本题考查了阿伏加德罗常数的计算,该题不难。
本题难度:一般
4、选择题 下列说法正确的是( )。
A.摩尔质量就等于相对分子质量
B.摩尔质量就是物质式量的6.02×1023倍
C.HNO3的摩尔质量是63 g
D.硫酸和磷酸的摩尔质量相等
参考答案:D
本题解析:一定条件下,摩尔质量与相对分子质量数值相同,但单位不同,前者的单位为g·mol-1。后者是比值,单位为1。D项根据化学式计算得硫酸和磷酸的相对分子质量都为98,故摩尔质量恰好相等,为98 g·mol-1。
本题难度:一般
5、实验题 (7分)⑴用18mol/L浓硫酸配制100mL 1.0mol/L的稀硫酸,若实验仪器有:
A.100mL量筒 B.玻璃棒 C.托盘天平 D.50mL容量瓶
E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
实验时必须选用的仪器是(填入字母)
⑵在配制过程中,下列操作不正确的是 A.使用容量瓶前需检查它是否漏水
B.容量瓶用蒸馏水洗净后,一定要干燥后再使用
C.配制溶液时,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水至刻度线
D.定容后盖好瓶塞,反复上下颠倒,摇匀
⑶若实验时遇到下列情况,将使所配溶液的浓度 (填“偏高”、“偏低”或“无影响”)
A.定容时俯视读数
B.未将洗涤液转入容量瓶
C.洗涤量筒,并将洗涤液转入容量瓶
参考答案:(1)BEFGH (2)BC (3)偏高 偏低 偏高
本题解析:(1)由溶液配制一定物质的量浓度的溶液需要的仪器有:玻璃棒、100mL容量瓶、10mL量筒,胶头滴管、50mL烧杯。因此选BEFGH。
(2)容量瓶不需要干燥使用,B项错误,定容操作应该用胶头滴管,C项错误。
(3)根据c=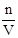 ,定容时俯视刻度,溶液的体积小于正常值,浓度偏高;未将洗涤液转入容量瓶,溶质的物质的量小于正常值,浓度偏低;洗涤量筒并将洗涤液转入容量瓶,溶质的物质的量大于正常值,浓度偏高。
,定容时俯视刻度,溶液的体积小于正常值,浓度偏高;未将洗涤液转入容量瓶,溶质的物质的量小于正常值,浓度偏低;洗涤量筒并将洗涤液转入容量瓶,溶质的物质的量大于正常值,浓度偏高。
考点:物质的量浓度溶液的配制
点评:本题非常基础简单,主要考查学生的实验能力和分析能力。
本题难度:一般