1、选择题 在4Zn+10HNO3==4Zn(NO3)2+N2O+5H2O反应中,被还原的HNO3与未被还原的HNO3的质量比为
A.2∶5
B.1∶4
C.4∶1
D.5∶1
参考答案:B
本题解析:考查氧化还原反应的有关计算,一般遵循电子的得失守恒。根据方程式可知,4mol锌失去8mol电子。应用氮元素的化合价从+5价降低到+1价,得到4个电子,所以根据电子的得失守恒可知,被还原的硝酸是8mol÷4=2mol,则没有被还原的硝酸是8mol,因此被还原的HNO3与未被还原的HNO3的质量比为1∶4,答案选B。
本题难度:一般
2、填空题 下列反应中,哪些元素被氧化?哪些元素被还原? 用双线桥法标出电子得失数目,指出氧化剂、还原剂。
(1) 2KNO3+3C+S K2S+N2↑+3CO2↑____________________________
K2S+N2↑+3CO2↑____________________________
(2)3Cl2+6KOH=5KCl+KClO3+3H2O____________________________
(3)KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O____________________________
参考答案:(1)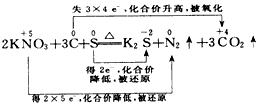 ;还原剂:C,氧化剂:KNO3、S
;还原剂:C,氧化剂:KNO3、S
(2) ;Cl2既是氧化剂又是还原剂
;Cl2既是氧化剂又是还原剂
(3) ;氧化剂:KClO3,还原剂:HCl
;氧化剂:KClO3,还原剂:HCl
本题解析:
本题难度:一般
3、填空题 现有一未配平的氧化还原反应:
KClO3+PH3+H2SO4→K2SO4+H3PO4+H2O+X
(1)该反应的还原剂是_________。
(2)已知0.2 mol KClO3在反应中得到1 mol电子生成X,则X的化学式是__________。
(3)根据上述反应可推知__________________(填写序号)。
A.氧化性:KClO3>H3PO4
B.氧化性:H3PO4>KClO3
C.还原性:PH3>X
D.还原性:X>PH3
参考答案:(1)PH3(2)Cl2?(3)AC
本题解析:(1)该反应中P元素的化合价由-3价升高为+5价,则PH3为还原剂;(2)设还原产物X中Cl元素的化合价为x,由电子转移可知,0.2mol×(5-x)=1mol,解得x=0,则还原产物X为Cl2;(3)氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性,则氧化性为KClO3>H3PO4,还原性为PH3>X,选AC。
本题难度:一般
4、填空题 (7分)已知溴单质的氧化性介于氯和碘之间,利用这一性质解决下面问题。
(1)下列物质或微粒中,在酸性条件下可能氧化Br-的是?(填序号)。?
A.I2? B. MnO4-? C.MnO2? D.Cl-
(2)把滤纸用淀粉和碘化钾的混合溶液浸泡、晾干后可获得实验常用的淀粉碘化钾试纸。这种试纸润湿后,遇少量氯气可观察到试纸变蓝,用化学方程式解释该现象:? 。
(3)下列试剂不能把NaCl和KI两种无色溶液区别开的是?(填序号)。
A.氯水?B.溴水?C.淀粉溶液? D.稀硝酸
(4)100mL溴化 亚铁溶液中通入3.36L氯气(标况),充分反应后测得溶液中氯离子与溴离子的物质的量浓度相等,则原溴化亚铁溶液的物质的量浓度为?。
亚铁溶液中通入3.36L氯气(标况),充分反应后测得溶液中氯离子与溴离子的物质的量浓度相等,则原溴化亚铁溶液的物质的量浓度为?。
参考答案:(7分)(1)BC (2分)?(2)Cl2 +2 KI ="2" KCl + I2(2分)
(3)C?(1分)?(4)2mol/L(2分)
本题解析:略
本题难度:一般
5、填空题 某铜矿石含氧化铜、氧化亚铜、三氧化二铁和大量脉石(SiO2),现采用酸浸法从矿石中提取铜,其流程图如下:
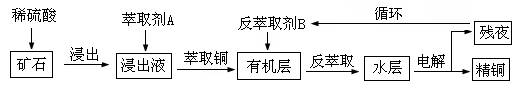
已知: ①当矿石中三氧化二铁含量太低时,可用硫酸和硫酸铁的混合液浸出铜;②反萃取后的水层是硫酸铜溶液,Cu2+浓度约为50g/L。回答下列问题:
(1)矿石用稀硫酸浸出过程中氧化亚铜发生的反应为:Cu2O+2H+===Cu2++Cu+H2O;请写出该过程中发生的另一个氧化还原反应的离子方程式:?。
(2)写出用惰性电极电解水层的电解总反应方程式:?。
(3)循环中反萃取剂B的主要成分是?。
(4)某铜矿石样品中,若仅含氧化亚铜、三氧化二铁和脉石三种物质。取该矿石样品200.0g,用100mL1.0mol?L—1H2SO4溶液浸取后,还需加入10mL 1.0mol?L—1 Fe2(SO4)3溶液才能使铜全部浸出,浸取液经充分电解后可得到 6.4gCu。求铜矿石样品中氧化亚铜和氧化铁的质量分数?
参考答案:(12分)(1)Cu+2Fe3+=2Fe2++ Cu2+(2分)
(2)2CuSO4 + 2H2O  O2↑+ 2Cu + 2H2SO4(2分)
O2↑+ 2Cu + 2H2SO4(2分)
(3)H2SO4(2分)?(4)Cu2O:3.6% (3分)? Fe2O3:3.2%(3分)
本题解析:(1)氧化铜、三氧化二铁均可以和强酸发生反应生成盐和水,CuO+2H+=Cu2++H2O、Fe2O3+6H+=2Fe3++3H2O。而金属铜和三价铁之间可以发生氧化还原反应,即Cu+2Fe3+=2Fe2++Cu2+。
(2)惰性电极电解硫酸铜的化学方程式是2CuSO4 + 2H2O  O2↑+ 2Cu + 2H2SO4。
O2↑+ 2Cu + 2H2SO4。
(3)由于硫酸铜易溶在无机溶剂中,所以循环中反萃取剂B的主要成分是稀硫酸。
(4)电解后生成的铜的质量是6.4g,物质的量是0.1mol,则根据原子守恒可知氧化亚铜的物质的量是0.05mol,所以铜矿石样品中氧化亚铜质量分数是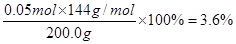 ;
;
根据方程式Cu2O+2H+=Cu2++Cu+H2O,反应中生成的铜是0.05mol。则根据Cu+2Fe3+=2Fe2++ Cu2+可知与铜反应的硫酸铁是0.05mol,其中有0.01L×1.0mol/L=0.01mol硫酸铁是另外加入的,则氧化铁和稀硫酸反应生成的硫酸铁是0.04mol,则氧化铁的物质的量是0.04mol,所以氧化铁的质量分数是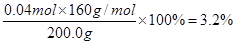 。
。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,难易适中,侧重对学生基础知识的巩固与训练,同时也注重对学生答题能力的培养和方法指导,有利于培养学生的逻辑思维能力和发散思维能力。该类试题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。
本题难度:一般