|
|
|
高考化学知识点总结《化学反应速率》考点特训(2017年冲刺版)(二)
2018-03-17 06:02:11
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 入大量SO3 D.降低体系温度
参考答案:AC
本题解析:根据外界条件对化学反应速率的影响分析,能改变反应速率的措施有温度、压强、浓度、催化剂等.A通入大量氧气,增大反应物的浓度,能增大正反应速率,故A正确.
B、增大容器容积,减小了体系的压强,压强减小,正反应速率减小,故B错误.
C、通入三氧化硫,反应物的浓度不变,生成物的浓度增大,化学平衡向逆反应方向移动,所以正反应速率逐渐增大,故C正确.
D、降低体系的温度,正逆反应速率都减小,故D错误.
本题难度:简单
2、选择题 恒温密闭容器中,某反应的化学反应速率随时间变化关系如图所示,下列说法不符合该图示的是( )
A.达到平衡时,正逆反应速率相等
B.增大反应物的浓度,反应由平衡I变化到平衡II
C.反应达到平衡I以后,减小反应物浓度,平衡移动到II
D.反应达到平衡II时的化学反应速率比平衡I时的大
| 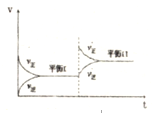
参考答案:A.当正逆反应速率相等时,各物质的浓度不变,达到平衡状态,故A正确;
B.在平衡Ⅰ的基础上正反应速率增大,而逆反应速率在原来基础上逐渐增大,且正反应速率大于逆反应速率,应为增大反应物的浓度,故B正确;
C.如反应物减小,则正逆反应速率都减小,且逆反应速率大于正反应速率,故C错误;
D.由图象可知,纵坐标为反应速率,反应达到平衡II时的化学反应速率比平衡I时的大,故D正确.
故选C.
本题解析:
本题难度:简单
3、填空题 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。 CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
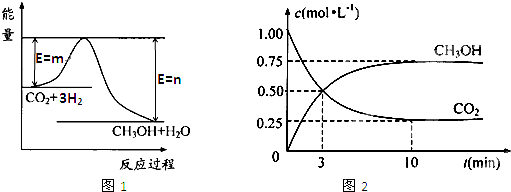
(1)写出该反应的热化学方程式 。
(2)关于该反应的下列说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S<0 D.△H<0,△S>0
(3)该反应的平衡常数K的表达式为: 。
(4)温度降低,平衡常数K (填“增大”、 “不变”或“减小”)。
(5)为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)= 。
(6)下列措施中能使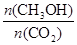 增大的有 。 增大的有 。
A.升高温度
B.加入催化剂
C.将H2O(g)从体系中分离
D.体积不变,充入He(g)使体系总压强增大
参考答案:(1)CO2(g)+3H2(g)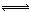 CH3OH(g)+H2O (g) △H=-(n-m)kJ?mol?1(2分) CH3OH(g)+H2O (g) △H=-(n-m)kJ?mol?1(2分)
(2)C(1分) (3)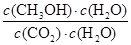 (1分) (1分)
(4)增大(1分) (5)0.225mol/(L·min)(1分) (6)C(1分)
本题解析:(1)该工业方法制取甲醇原理为二氧化碳与氢气反应生成甲醇和水,根据图像可知,反应物的总能量高于生成物的总能量,因此该反应是放热反应。反应热等于反应物的总能量和生成物总能量的差值,因此该反应的热化学方程式为CO2(g)+3H2(g)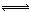 CH3OH(g)+H2O (g) △H=-(n-m)kJ?mol?1。 CH3OH(g)+H2O (g) △H=-(n-m)kJ?mol?1。
(2)由图1可知,反应物的总能量高于生成物的总能量,该反应为放热反应,即△H<0;由方程式可知,该反应正反应是气体的物质的量减小的反应,故正反应为熵减过程,即△S<0,所以答案选C。
(3)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据可逆反应可逆反应CO2(g)+3H2(g)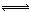 CH3OH(g)+H2O (g)可知,该可逆反应的平衡常数K= CH3OH(g)+H2O (g)可知,该可逆反应的平衡常数K=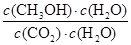 。 。
(4)该反应正反应是放热反应,降低温度平衡向正反应移动,平衡常数增大。
(5)由图2可知,10min达平衡时甲醇的浓度变化量为0.75mol/L,所以v(CH3OH)=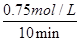 =0.075mol?L-1?min-1。又因为反应速率之比等于化学计量数之比,因此v(H2)=3v(CH3OH)=0.075mol?L-1?min-1×3=0.225mol?L-1?min-1。 =0.075mol?L-1?min-1。又因为反应速率之比等于化学计量数之比,因此v(H2)=3v(CH3OH)=0.075mol?L-1?min-1×3=0.225mol?L-1?min-1。
(6)使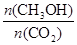 增大,改变条件使平衡向正反应移动即可。但只增大二氧化碳的浓度会使该比值减小,则A、升高温度,平衡向逆反应移动, 增大,改变条件使平衡向正反应移动即可。但只增大二氧化碳的浓度会使该比值减小,则A、升高温度,平衡向逆反应移动,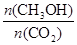 减小,故A错误;B、加入催化剂,平衡不移动, 减小,故A错误;B、加入催化剂,平衡不移动,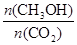 不变,故B错误;C、将H2O(g)从体系中分离,平衡向正反应移动, 不变,故B错误;C、将H2O(g)从体系中分离,平衡向正反应移动,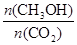 增大,故C正确;D、充入He(g),压强增大,但反应混合物的浓度不变,平衡不移动, 增大,故C正确;D、充入He(g),压强增大,但反应混合物的浓度不变,平衡不移动,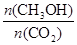 不变,故D错误;答案选C。 不变,故D错误;答案选C。
考点:考查热化学方程式的书写、外界条件对平衡状态和平衡常数的影响、反应速率的计算等
本题难度:困难
4、选择题 实验室可用铁片与稀硫酸反应制取氢气,下列措施不能使氢气生成速率增大的是( )
A.加热
B.增大压强
C.滴加少量浓盐酸
D.不用铁片,改用铁粉
参考答案:A、加热能使反应速率加快,故A正确;
B、该反应的实质是铁与氢离子反应,反应物中没有气体,则增大压强对反应速率无影响,故B错误;
C、滴加少量浓盐酸,增大了溶液中氢离子的浓度,则加快反应速率,故C正确;
D、改用铁粉,增大了反应物的接触面积,反应速率加快,故D正确;
故选B.
本题解析:
本题难度:一般
5、选择题 下列与化学反应能量变化相关的叙述正确的是
A.2CH3CH2OH(l)+6O2(g)===4CO2(g)+6H2O(l) ΔH=-1367kJ/mol,可见乙醇燃烧热ΔH=-1367 kJ/mol
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
|
参考答案:C
本题解析:A、根据燃烧热的概念:“在25℃,101kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热,单位为kJ/mol。”乙醇的物质的量应为1mol,A错误;B、反应速率与反应是吸热还是放热没有必然的联系,B错误;C、化学反应的反应热大小取决于反应物和生成物的总能量大小,与反应途径无关,应用盖斯定律,可计算某些难以直接测量的反应焓变,C正确;D、根据△H=生成物的焓-反应物的焓可知,焓变与反应条件无关,在光照和点燃条件下该反应的△H相同,D错误,选C。
考点:考查化学反应中的能量变化。
本题难度:一般
