|
高中化学知识点总结《大气污染与治理》试题特训(2017年最新版)(二)
2018-03-17 06:06:17
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 (10 分)SO2和NOx的排放是造成酸雨的两大罪魁祸首。下图表示了某地区在1940~2002年间,空气中SO2和NOx含量因燃料燃烧、工业生产、交通运输以及其他因素的影响而发生变化的基本统计数据。
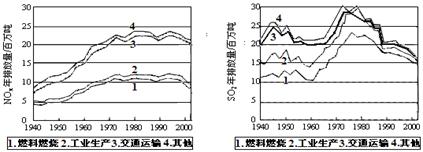
(1)结合上图数据,判断下列说法正确的是? ▲?。
A.在交通运输中排放的NOx与燃料的不充分燃烧有关
B.在上世纪60年代以前,在交通运输中排放的SO2主要是使用燃煤的内燃机所致
C.近年来在工业生产中SO2排放量的下降,主要是减少了燃烧的煤的质量
D.随着汽车工业的发展,在形成酸雨的因素中,NOx所占比重在逐渐增大
| (2)在上图表示的历史进程中,由工业生产所导致的SO2的排放量明显地在逐年减少。请用化学方程式说明人类在为解决SO2污染问题中所进行的一个反应过程:
? ▲?。
(3)汽车排放的尾气中含有未燃烧充分的CmHn、以及N2、CO2、NO、CO等。有人设计利用反应2NO + 2CO  ?N2 + 2CO2将有害的污染物转化为可参与大气循环的N2和CO2。 ?N2 + 2CO2将有害的污染物转化为可参与大气循环的N2和CO2。
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
时间/h
| 0
| 1
| 2
| 3
| 4
| 5
| c(NO)/mol·L-1
| 1.00×10-3
| 4.5×10-4
| 2.5×10-4
| 1.5×10-4
| 1.00×10-4
| 1.00×10-4
| c(CO)/mol·L-1
| 3.6×10-3
| 3.05×10-3
| 2.85×10-3
| 2.75×10-3
| 2.70×10-3
| 2.70×10-3
|
    在上述条件下反应能够自发进行,则反应的 在上述条件下反应能够自发进行,则反应的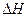 ? ▲?0(“>”、“<”、“=”)。 ? ▲?0(“>”、“<”、“=”)。 在该温度下,反应的平衡常数K=? ▲?。 在该温度下,反应的平衡常数K=? ▲?。
(4)某次降雨过程收集到10L的雨水,向雨水中滴加1mL6mol/L的H2O2,充分反应后测得溶液的pH="3.62" [c(H+) =2.4×10-4 mol/L ]),再向溶液中加入足量的Ba(OH)2溶液,经过滤、晾干、称重,得沉淀的质量为0.1864g。若假设雨水的酸性仅由NOx和SO2的排放所致。请计算排放在空气中的NOx和SO2的物质的量之比接近于? ▲?。
参考答案:(1)BD
(2)CaCO3 + SO2 CaSO3 + CO2或2CaCO3 + 2SO2 + O2 CaSO3 + CO2或2CaCO3 + 2SO2 + O2 2CaSO4 + 2CO2 2CaSO4 + 2CO2
(3)<? 5000
(4)1:1? (每空2分,共10分)
本题解析:略
本题难度:一般
2、选择题 空气污染已成为人类面临的重大威胁。下列气体中,不会造成空气污染是
A.N2
B.Cl2
C.SO2
D.NO2
参考答案:A
本题解析:氯气、二氧化硫、二氧化氮均为有毒气体,可造成大气污染,而氮气本身就是大气的主要成分,不会造成空气污染,答案为A
本题难度:简单
3、选择题 2012年2月,国务院同意发布新修订的《环境空气质量标准》增加了PM2.5监测指标。PM2.5是指大气中直径小于或等于2.5微米的可吸入肺颗粒物,对人体伤害很大。PM2.5来源广泛,下列不可能是PM2.5来源的是( )
A.风扬尘土
B.汽车尾气
C.餐饮油烟
D.水力发电
参考答案:D
本题解析:考查化学与生活、生产及环境保护等。答案选D。
本题难度:简单
4、填空题 汽车尾气中含有NOx、CO及碳氢化合物,直接排入空气会造成大气污染,某研究性学习小组拟探究汽车尾气相关问题,请你参与并回答问题。
(1)有人建议汽车尾气中的CO,可用加入催化剂催化热分解的方法消除。已知热分解反应
CO(g)=c(s)+O2(g)的△H=+110.5kJ/mol,△S=-0.089kJ·mol-1.K-1,这一方案理论上是否可行,____________(选填:“可行”或“不可行”)。
 ? (2)有人提议在一定的条件下使NO、CO两种气体反应转变为N2和CO2,其方程式可表示为:2NO(g)+2CO(g)? N2(g)+2CO2(g) △H=-373.4kJ/mol.△S<0,又知该反应的平衡常数极大,常温下反应速率极小。 ? (2)有人提议在一定的条件下使NO、CO两种气体反应转变为N2和CO2,其方程式可表示为:2NO(g)+2CO(g)? N2(g)+2CO2(g) △H=-373.4kJ/mol.△S<0,又知该反应的平衡常数极大,常温下反应速率极小。
①上述反应的平衡常数表达式为:_________________________。
②下列有关说法正确的是_____________________________
A.减少CO和NO浓度的有效方法是加长汽车尾气排气管的长度
B.提高NO及CO转化率的有效方法是低温催化
C.汽车尾气中的NO主要是由于石油中含有大量的氮元素
D.使用催化剂,在适当温度和压力下有利干提高上述反应转化效率
(3)测定汽车尾气中NO,NO2的方法之一,用3%的H2o2溶液吸收生成HNO3,再用NaOH标准溶液滴定。若要确定尾气中NO,NO2体积分数总和,所需的数据有___________(选填序号)。
A.气体样品的体积? B.NaOH标准溶液的浓度及所消耗的体积
C.从滴定开始到指示剂变色所需的时间? D.两种氮氧化物的体积比
参考答案:
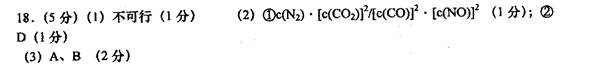
本题解析:(1)对应一个化学反应而言,当△H=-373.4kJ/mol.△S<0时在低温下自发,故不可行。(2)反应温度太低会极大地降低反应速率;(3)先确定实验方案的选择,再逐一研究需要测量的物理量。
本题难度:一般
5、填空题 为了获取大量的生活饮用水,自来水厂需要用适宜、高效的方法和流程将天然水悬浮物、致病细菌等有害成分降低到规定的含量。
(1)要达到上述目的,一般要经过的基本步骤是:①沉降、②?、③曝气、④?。“曝气”的主要目的是?。
(2)在第①步中,下列物质可以使用的是?(用符号填空)。
A.明矾 ?B.膨润土 ?C.烧碱
(3)在将天然水制成生活饮用水的过程中,水中不需要除去的成分是?(至少答出一项)。
(4)在经过上述四个步骤的处理之后,如果水中Ca2+、Mg2+的含量超标,还要将水进行?。
参考答案:(1)过滤 消毒 增加水中的含氧量,加速水中有机物的分解
(2)AB
(3)对人体有益的矿物质等
(4)软化
本题解析:在沉降之后必然是过滤。加消毒剂也是必不可少的步骤之一。“曝气”就是使水暴露在空气中,使水与空气接触的面积增大,增加水中的含氧量,以加速水中有机物的分解。明矾可做水的混凝剂,膨润土可做水的辅助混凝剂。对人体有益的矿物质等最好不要除去。降低水中Ca2+、Mg2+含量的过程叫做硬水的软化。
本题难度:一般
|  ?N2 + 2CO2将有害的污染物转化为可参与大气循环的N2和CO2。
?N2 + 2CO2将有害的污染物转化为可参与大气循环的N2和CO2。


 在上述条件下反应能够自发进行,则反应的
在上述条件下反应能够自发进行,则反应的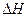 ? ▲?0(“>”、“<”、“=”)。
? ▲?0(“>”、“<”、“=”)。 在该温度下,反应的平衡常数K=? ▲?。
在该温度下,反应的平衡常数K=? ▲?。