| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《物质的量》考点特训(2017年冲刺版)(六)
参考答案:A 本题解析:误差分析:天平(使用游码)称量时,被称量物与砝码的位置放颠倒了,物质的质量=砝码的质量- 游码的质量,质量偏小,浓度偏低;溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤,物质的质量偏小,浓度偏低;定容时,俯视容量瓶的刻度线,体积小了,浓度偏高;定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线,体积大了,浓度偏低。 本题难度:一般 2、选择题 摩尔是 |
参考答案:C
本题解析:物质的量是国际单位制中一个基本物理量,而摩尔是其单位。
本题难度:一般
3、选择题 有不纯的CuCl2,质量为13.5 g,与适量AgNO3溶液反应,可生成29.g沉淀,则该氯化铜中所含的杂质是下列中的()
A.KCl
B.CaCl2
C.BaCl2
D.NaCl
参考答案:BD
本题解析:本题如果按常规思路解题,非常烦琐,甚至无从下手。但如果把AgCl沉淀的质量折算成氯元素的质量,根据“元素守恒”和“中间值法”巧解,则较为方便。
方法一:29 g AgCl沉淀中含氯元素的质量为:
29 g×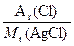 ="29" g×
="29" g×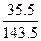 ="7.17" g
="7.17" g
13.5 g纯CuCl2中含氯元素的质量为:
13.5 g× ="13.5" g×
="13.5" g×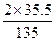 ="7.1" g
="7.1" g
因7.1 g<7.17 g,所以杂质中氯的质量分数>CuCl2中氯的质量分数。
通过比较,可知只有B、D选项符合题意。
方法二:极端假设法。
若13.5 g为纯CuCl2,则n(CuCl2)="0.1" mol,生成n(AgCl)="0.2" mol,AgCl沉淀质量为28.7 g,小于现有沉淀29 g,说明混入的杂质Cl-的含量应大于CuCl2中Cl-的含量。将选项中化学式变形:
A.2KCl? B.CaCl2?C.BaCl2?D.2NaCl
观察比较得知金属的相对原子质量小于CuCl2中Cu(64)的CaCl2和NaCl满足题意。
本题难度:简单
4、实验题 (9分)实验室用氯化钠固体配制1.0 mol·L-1的NaCl溶液500 mL,回答下列问题:
(1)实验所需玻璃仪器除玻烧杯、璃棒、量筒外还有 和
(2)使用容量瓶前首先要
(3) 下列操作对所配溶液的浓度有何影响?(填写字母)
①偏大的有_______________________________________________;
②偏小的有_______________________________________________;
③无影响的有_____________________________________________。
A.未洗涤溶解NaCl的烧杯
B.往容量瓶中移液时,有少量液体溅出
C.定容时俯视刻度线
D.容量瓶用蒸馏洗涤后残留有少量的水
E.定容后盖上瓶塞反复摇匀,静置后,发现液面不到刻度线,再加水至刻度线
(4)若配制时,因加水不慎略超过了容量瓶刻度线,此时实验应如何继续进行?
答:
参考答案:(1)500ml容量瓶 胶头滴管 (每空1分)
(2)①验漏(1分)(3)①C ②ABE ③D (共5分)
(4)重新配制。(1分)
本题解析:考查一定物质的量浓度溶液的配制及误差分析等。
(1)配制500ml溶液,因此需要500ml容量瓶;定容是还需要胶头滴管。
(2)使用容量瓶前首先要检验容量瓶是否漏水。
(3)根据c=n/V可知,未洗涤溶解NaCl的烧杯,则溶质减少,浓度偏小;往容量瓶中移液时,有少量液体溅出,则溶质减少,浓度偏小;定容时俯视刻度线,则溶液体积减小,浓度偏高;容量瓶用蒸馏洗涤后残留有少量的水,对实验结果没有影响;定容后盖上瓶塞反复摇匀,静置后,发现液面不到刻度线,再加水至刻度线,则溶液体积增加,浓度偏小。
(4)若配制时,因加水不慎略超过了容量瓶刻度线,实验失败,需要重新配制。
本题难度:一般
5、选择题 下列判断正确的是
A.0.5molNaCl溶解在1 L水中,所得溶液的物质的量浓度为0.5 mol/L
B.10mL 1 mol/L的硫酸溶液与100mL 1 mol/L的硫酸溶液的物质的量浓度不同
C.1mol任何气体所含的气体分子数目都相等
D.1molCH4的体积约为22.4L
参考答案:C
本题解析:略
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《物质的分离.. | |