1、选择题 下列物质属于具有固定熔沸点的是
A.C4H10
B.石炭酸
C.碱石灰
D.盐酸
参考答案:B
本题解析:考点:混合物和纯净物;同分异构现象和同分异构体.
分析:具有固定的熔点、沸点的物质一定是纯净物.据此判断.
A、C4H10存在同分异构体;
B、石碳酸是苯酚;
C、固体氢氧化钠和氧化钙的混合物叫做碱石灰;
D、盐酸是氯化氢的水溶液.
解:A、C4H10存在同分异构体,有正丁烷、异丁烷,C4H10不能表示纯净物,故A不符合;
B、石碳酸是苯酚,属于纯净物,故B符合;
C、碱石灰是固体氢氧化钠和氧化钙的混合物,故C不符合;
D、盐酸是氯化氢的水溶液,属于盐酸属于化合物,故D不符合.
故选B.
本题难度:困难
2、选择题 几种短周期元素的原子半径及主要化合价如下表:
元素代号
| X
| Y
| Z
| W
|
原子半径/10-12 m
| 160
| 110
| 70
| 66
|
主要化合价
| +2
| +5、+3、-3
| +5、+3、-3
| -2
|
?
下列叙述正确的是( )
A.离子半径:W2-<X2+
B.气态氢化物的稳定性:Z>W
C.化合物X3Z2中既含有离子键又含有共价键
D.最高价氧化物对应水化物的酸性:Z>Y
参考答案:D
本题解析:从化合价判定X是ⅡA族元素,Y、Z是ⅤA族元素,W是氧元素,再结合原子半径:X是Mg,Y是P,Z是N。O2-与Mg2+核外电子排布相同,Mg2+核电荷数大,半径小,A错;非金属性O>N,稳定性H2O>NH3,B选项错;化合物Mg3N2中只存在离子键,C选项错;酸性HNO3>H3PO4,D选项正确。
本题难度:简单
3、选择题 下列各组中前者的碱性比后者强的是(? )
A. KOH和Al(OH)3
B.Mg(OH)2和NaOH
C.Al(OH)3和Mg(OH)2
D.Mg(OH)2和Ca(OH)2
参考答案:A
本题解析:金属性越强对应的最高价氧化物的水化物的碱性越强,碱性:KOH>NaOH >Mg(OH)2> Al(OH)3、 Mg(OH)2>Ca(OH)2 ?BCD错误
本题难度:简单
4、选择题 2011年3月11日日本发生9级地震,福岛核电站发生核泄漏,主要放射性物质131? 53I,下列有关131? 53I叙述正确的是
A.131 53I是碘的一种同素异形体
B.131 53I是一种新发现的元素
C.131 53I核外电子数为131
D.131 53I核内的中子数与核外电子数之差为25
参考答案:D
本题解析:考查原子结构
A. I是碘的一种核素,不正确
I是碘的一种核素,不正确
B. I属于碘元素的一种原子,并非新元素
I属于碘元素的一种原子,并非新元素
C. I核外电子数为53
I核外电子数为53
D.正确
答案为D
本题难度:一般
5、填空题 (14分)下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
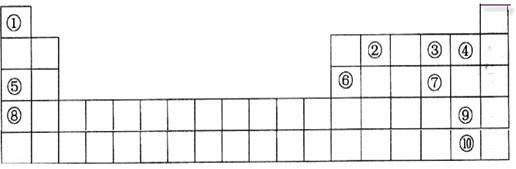
用化学符号回答下列问题:
(1)表中最活泼的金属与最活泼的非金属形成的物质是?;
(2)⑤、⑥、⑧的最高价水化物的碱性由强到弱的顺序是?;
③、④、⑦氢化物稳定性由强到弱的顺序是?;
(3)③与⑤按原子个数1:1所成的化合物的电子式为________________;该化合物与水反应的离子方程式为________________。
(4)⑥号元素最高氧化物水化物与⑤号元素最高价氧化物水化物反应的离子方程式为?;
(5)请设计一个实验方案,比较⑨、⑩的单质氧化性的强弱:?。
参考答案:(每空2)(1)KF(2)?KOH>NaOH>Al(OH)3?HF>H2O>H2S?
(3) ?2Na2O2+2H2O=4Na+ +4OH—+O2↑
?2Na2O2+2H2O=4Na+ +4OH—+O2↑
(4)Al(OH)3+OH- =AlO2-+2H2O
(5)将溴水加入碘化钠溶液中,再加入淀粉,若溶液变蓝,证明单质溴比单质碘氧化性强(其他合理答案也可)
本题解析:(1)表中最活泼的金属与最活泼的非金属分别是K和F,形成的化合物是KF。
(2)金属性越强,最高价氧化物的水化物的碱性越强。金属性是K>Na>Al,所以最高价水化物的碱性由强到弱的顺序是KOH>NaOH>Al(OH)3。非金属性越强,相应氢化物的稳定性越强,非金属性是F>O>S,所以相应氢化物的稳定性是HF>H2O>H2S。
(3)③与⑤按原子个数1:1所成的化合物是过氧化钠,其电子式为 。过氧化钠和水反应生成氢氧化钠和氧气,方程式为2Na2O2+2H2O=4Na+ +4OH—+O2↑。
。过氧化钠和水反应生成氢氧化钠和氧气,方程式为2Na2O2+2H2O=4Na+ +4OH—+O2↑。
(4)⑥号元素最高氧化物水化物与⑤号元素最高价氧化物水化物分别是氢氧化铝和氢氧化钠。由于氢氧化铝是两性氢氧化物,能和氢氧化钠反应,所以反应的方程式为Al(OH)3+OH- =AlO2-+2H2O。
(5)半径元素的非金属性强弱,可用非金属单质与盐溶液中简单阴离子之间的置换反应来验证,因为非金属性强的置换非金属性弱的。即将溴水加入碘化钠溶液中,再加入淀粉,若溶液变蓝,证明单质溴比单质碘氧化性强。
本题难度:一般