1、选择题 下列制备气体的实验设计中错误的是( )
选项
| A
| B
| C
| D
|
药品
| NH4Cl
与Ca(OH)2
| 石灰石和
稀盐酸
| 稀硝酸
和铜片
| KMnO4
与浓盐酸
|
装置
| 
| 
| 
| 
|
?
参考答案:C
本题解析:A装置是制取NH3,用碱石灰干燥,正确;B是简易启普发生器制取CO2,正确;C是制取NO,由于NO极易
被空气中的氧气氧化为NO2,所以只能用排水法收集,错误;KMnO4氧化性很强,与浓盐酸反应不需要加热,D正确。
本题难度:一般
2、实验题 某同学进行实验研究时,欲配1.0mol?L-1Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2·8H2O试剂(化学式量:315)。在室温下配制溶液时发现所取试剂在足量的水中仅部分溶解,烧杯中存在大量未溶物。为探究原因,该同学查得Ba(OH)2·8H2O在283K、293K和303K时的溶解度(g/100g H2O)分别为2.5、3.9和5.6。
(1)烧杯中未溶物可能仅为BaCO3,理由是___________________________________。
(2)假设试剂由大量Ba(OH)2·8H2O和少量BaCO3组成,设计实验方案,进行成分检验。在答题纸上进一步完成实验步骤、预期现象和结论。(不考虑结晶水的检验;室温时BaCO3饱和溶液的pH=9.6)
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、pH计、烧杯、试管、带塞导气管、滴管
实验步骤
| 预期现象和结论
|
 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。
| ?
|
步骤2:取适量滤液于试管中,滴加稀硫酸。
| ?
|
步骤3:取适量步骤1中的沉淀于试管中,_____。
| ?
|
步骤4:
| ?
|
?
将试剂初步提纯后,准确测定其中Ba(OH)2·8H2O的含量。实验如下:
(3)配制250ml 约0.1mol?L-1Ba(OH)2溶液:准确称取w克试样,置于烧杯中,加适量蒸馏水,__________,将溶液转入_____________,洗涤,定容,摇匀。
(4)滴定:准确量取25.00ml所配制Ba(OH)2溶液于锥形瓶中,滴加指示剂,将__________(填“0.020”、“0.05”、“0.1980”或“1.5”)mol?L-1盐酸装入50ml酸式滴定管,滴定至终点,记录数据。重复滴定2次。平均消耗盐酸Vml。 计算Ba(OH)2·8H2O的质量分数=__________________(只列出算式,不做运算)
(5)室温下,________(填“能”或“不能”) 配制1.0 mol?L-1Ba(OH)2溶液。
参考答案:(本题共12分) (1)由于Ba(OH)2·8H2O与空气中的CO2反应,所取试剂许多已变质为BaCO3,未变质的Ba(OH)2·8H2O在配制溶液时能全部溶解。(2分)?
(2)(5分)
实验步骤
预期现象和结论
步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。
?
步骤2:取适量滤液于试管中,滴加稀硫酸。
出现白色沉淀,说明该试剂中有Ba2+存在
步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,连接带塞导气管将产生的气体导入澄清石灰水中。
澄清石灰水变混浊。说明该试剂中含有BaCO3
步骤4:取步骤1中的滤液于烧杯中,用pH计测定其pH。
pH明显大于9.6,说明该试剂中含有Ba(OH)2。
?
(3)搅拌溶解? 250ml容量瓶中 (2分)?
(4)(2分)0.1980;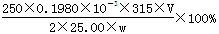
(5)不能。 (1分)
本题解析:(1)Ba(OH)2属于强碱,易吸收空气中的水蒸气和CO2形成难溶的BaCO3沉淀,因此长时间暴露在空气中时Ba(OH)2就有可能转化为BaCO3。
(2)Ba(OH)2易溶于水,所以滤液中含有Ba2+,因此滴加稀硫酸使会产生白色沉淀BaSO4;要想验证沉淀为BaCO3,可以利用其能与酸反应产生能使澄清石灰水变浑浊的CO2气体;为进一步证明试剂是是否还有Ba(OH)2·8H2O,可以取步骤1中的滤液,用pH计测其pH值,若pH>9.6,即证明滤液不是纯BaCO3溶液,即证明是由大量Ba(OH)2·8H2O和少量BaCO3组成,假设成立。
(3)由于试样中含有难溶性的BaCO3,因此加水溶解后要过滤,且冷却后再转移到250ml容量瓶中。
(4)Ba(OH)2溶液的浓度约为0.1mol?L-1,体积是25ml,由于酸式滴定管的容量是50ml,因此盐酸的浓度至少应该是0.1 mol?L-1的.若盐酸的浓度过大,反应过快,不利于控制滴定终点,所以选择0.1980 mol?L-1的盐酸最恰当。消耗盐酸的物质的量是0.1980×V×10-3mol,所以25.00ml溶液中含有Ba(OH)2的物质的量是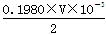 mol,所以w克试样中Ba(OH)2的质量是
mol,所以w克试样中Ba(OH)2的质量是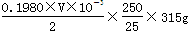 ,故Ba(OH)2·8H2O的质量分数=
,故Ba(OH)2·8H2O的质量分数=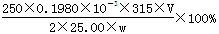 。
。
(5)若配制1L1.0 mol?L-1Ba(OH)2溶液,则溶液中溶解的Ba(OH)2·8H2O的质量是315g,所以此时的溶解度约是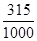 ×100=31.5 g/100g H2O,而在常温下Ba(OH)2·8H2O是3.9 g/100g H2O,显然不可能配制出1.0 mol?L-1Ba(OH)2溶液。
×100=31.5 g/100g H2O,而在常温下Ba(OH)2·8H2O是3.9 g/100g H2O,显然不可能配制出1.0 mol?L-1Ba(OH)2溶液。
本题难度:一般
3、选择题 下列说法不正确的是
A.用移液管移取10 mL NaOH溶液放于锥形瓶中,移液管的尖嘴和锥形瓶内壁一定要接触
B.实验室制硝基苯时,先将硝酸与浓硫酸混合,冷却后边振荡边滴加苯
C.制备硝酸钾晶体实验中先后进行了二次过滤,分别是先常温减压过滤、后高温常压过滤
D.受溴腐蚀致伤:先用苯或甘油洗伤口,再用水洗
参考答案:C
本题解析:用移液管移取10 mL NaOH溶液放于锥形瓶中,移液管的尖嘴和锥形瓶内壁一定要接触,A正确;苯易挥发,所以实验室制硝基苯时,先将硝酸与浓硫酸混合,冷却后边振荡边滴加苯,B正确;制备硝酸钾晶体实验中先后进行了二次过滤,第一次,需要高温蒸发浓缩,使得由于水的减少而析出结晶硝酸钾,为第二步结晶降温析出做准备。第二次是重结晶,因为此时是硝酸钾的饱和溶液需降温结晶,即先高温常压过滤,后常温减压过滤,C不正确;溴易溶在有机溶剂中,受溴腐蚀致伤:先用苯或甘油洗伤口,再用水洗,所以选项D正确,答案选C,
点评:化学实验常用仪器的使用方法和化学实验基本操作是进行化学实验的基础,对化学实验的考查离不开化学实验的基本操作,所以过量试题主要是以常见仪器的选用、实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。:
本题难度:一般
4、选择题 下列装置或操作能达到实验目的是(?)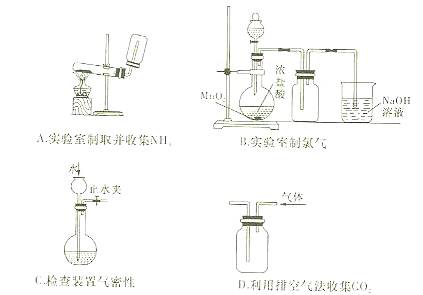
参考答案:C
本题解析:略
本题难度:简单
5、选择题 下列常用实验仪器中,能直接加热的是(? )。
A.分液漏斗
B.普通漏斗
C.蒸馏烧瓶
D.试管
参考答案:D
本题解析:考察了仪器的使用方法,漏斗不能加热,而蒸馏烧瓶需要用石棉网才能加热。
本题难度:简单