1、计算题 在120℃时,将气体A 3.88 g通过足量的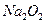 ,放出
,放出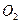 ,充分反应后固体的质量增加2.28 g,试通过计算判断气体 A的组成及各成分的质量。
,充分反应后固体的质量增加2.28 g,试通过计算判断气体 A的组成及各成分的质量。
参考答案:如果A都是 ,设其质量为
,设其质量为 ,
,
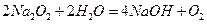 ?
?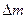 ?
?
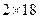 ? 32?4
? 32?4
 ?2.28g
?2.28g
 ,故假设不成立。
,故假设不成立。
如果A都是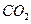 ,设其质量为
,设其质量为 :
:
 ?
?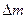
88? 32?56
 ?2.28g
?2.28g
 ,故假设不成立。
,故假设不成立。
所以A应为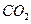 和
和 的混合物
的混合物
设 的质量为
的质量为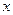 ?g,
?g,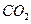 的质量为
的质量为 ?g,则
?g,则 ,
, 。
。
本题解析:120℃能和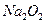 反应放出
反应放出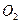 的气体有可能是
的气体有可能是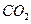 和
和 ,因此首先判断A是什么物质?可采用极端假设法。
,因此首先判断A是什么物质?可采用极端假设法。
本题难度:一般
2、填空题 (13分)钠、氯及其化合物有如下转化关系,请按要求填空:
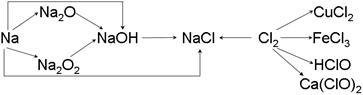
(1)金属钠的密度比水?,实验室中金属钠通常保存在?中。一小块金属钠投入水中的反应方程式是?。
(2)Na2O2 是?色的固体,Na2O2 的重要用途是?,有关反应的化学方程式为?。
(3)通常情况下,为了防止污染环境,在做完实验后,多余的氯气应用NaOH溶液吸收,其化学方程式为 ? ?。
(4)漂白粉的有效成份是?(填化学式),漂白粉溶于水后,受空气中的CO2作用,产生有漂白、杀菌作用的次氯酸,化学方程式为?。
参考答案:(13分)(1)小?煤油(各1分)? 2Na+ 2H2O=2NaOH+H2↑ (2分)
(2)淡黄?做呼吸面具?(各1分)? 2Na2O2+2CO2=2Na2CO3+O2(2分)
(3)Cl2 +2NaOH="NaCl" + NaClO + H2O(2分)
(4)Ca(ClO)2 ?(1分) Ca(ClO)2 + CO2 + H2O ="=" CaCO3↓+ 2 HClO?(2分)
本题解析:考查钠、氯气及其化合物的性质和有关用途。
(1)金属钠的密度小于水的,由于金属钠极易被氧化和吸水,所以应该不存在煤油中。钠和水反应生成氢氧化和氢气,反应的方程式是2Na+ 2H2O=2NaOH+H2↑ 。
(2)过氧化钠是淡黄色固体,其主要的用途是做呼吸面具的供养剂,反应的方程式是2Na2O2+2CO2=2Na2CO3+O2、2Na2O2+2H2O=4NaOH+O2。
(3)氯气有毒,需要尾气处理,反应的方程式是Cl2 +2NaOH="NaCl" + NaClO + H2O。
(4)漂白粉是混合物,主要成分是次氯酸钙和氯化钙,其有效成份是次氯酸钙;碳酸的酸性强于次氯酸的,所以次氯酸钙能吸收CO2和水蒸气生成次氯酸,反应的方程式是Ca(ClO)2 + CO2 + H2O ="=" CaCO3↓+ 2 HClO。
本题难度:一般
3、计算题 KOH和KHCO3固体的混合物25.6 g,于250 ℃进行煅烧,冷却后混合物质量损失了4.9 g。
(1)求起始混合物的百分组成。
(2)若混合物的质量损失改为2.1 g,这时起始混合物的百分组成又是多少?
参考答案:21.875%和78.125%;45.6%和54.4%。
本题解析:用“差量法”判断谁过量。
假设25.6 g混合物是由KOH和KHCO3恰好完全反应的质量比混合而成的,则

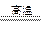 K2CO3+H2O?差量
K2CO3+H2O?差量
156? 18
25.6 g? x
经计算,求得理论差量x="2.95" g。
题目中,第一种情况实际差量>2.95 g,为KHCO3过量。由“钾守恒”,残留的固体25.6 g-4.9 g="20.7" g为K2CO3,则通过列二元方程组,可求得KOH和KHCO3固体各自的质量。题目中,第二种情况实际差量<2.95 g,为KOH过量,由方程式运算可直接求得KHCO3的质量。
本题难度:简单
4、选择题 下列关于Na2O2说法正确的是
[? ]
A.与SO2反应生成Na2SO3与O2
B.Na2O2投入到品红溶液中,品红溶液褪色
C.Na2O2能与酸反应生成盐和水,所以Na2O2是碱性氧化物
D.Na2O2与水反应,Na2O2是氧化剂,水是还原剂
参考答案:B
本题解析:
本题难度:简单
5、填空题 (6分)化学提高了人们生存的质量,生活质量的提高又促进了化学发展。
(1)柠檬中富含钾、钠、钙、柠檬酸等,属于?性食品(填“酸性”或“碱性”);
(2)阿司匹林是人们熟知的治感冒药,具有解热镇痛作用。但长期大量使用会出现不良反应,如水杨酸反应。若出现水杨酸反应,应立即停药,并静脉滴注?溶液。
(3)某品牌抗酸药的主要成分有糖衣、碳酸镁、氢氧化铝、淀粉。
写出该抗酸药发挥功效时的离子方程式:
? ?、?。
?、?。
参考答案:酸? NaHC O3?MgCO3+2H+ = Mg2
O3?MgCO3+2H+ = Mg2 ++CO2?+H2O↑? Al(OH)3+3H+=Al3++3H2O
++CO2?+H2O↑? Al(OH)3+3H+=Al3++3H2O
本题解析:略
本题难度:一般