| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《物质的量》试题预测(2017年最新版)(四)
参考答案:C 本题解析:A、浓硫酸的密度大于水,随着硫酸浓度的增大密度增大,因此10 mL质量分数为98%的H2SO4,用水稀释至100 mL,H2SO4的质量分数大于9.8%,A错误;B、1molFe与过量的稀HNO3反应,转移的电子数为3NA,B错误;C、CO和乙烯的相对分子质量均是28,所以标准状况下,分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g,C正确;铵盐溶于水,铵根水解,所以一定温度下,l L 0.50 mol/LNH4C1溶液与2 L0.25mol/LNH4C1溶液NH4+的离子数均小于0.5NA,D错误,答案选C。 本题难度:困难 2、选择题 用NA表示阿伏加德罗常数的值,下列说法正确的是( ) |
参考答案:B
本题解析:本题考查阿伏加德罗常数有关知识。1 mol过氧化钠(Na2O2)中阴离子(O22-)所带的负电荷数应为2NA,A不正确;乙烯和丙烯的最简式都是CH2,故14 g中混合物所含的碳原子数为14g/(14g/mol)=1mol,即碳原子数目为NA,B正确;28 g C16O中含有的质子数为14 NA,28 g C18O中含有的质子数为28 g/(30g/mol)="(14/15)" mol,即质子数为14 ×(14/15)NA<14 NA,C不正确;由Cl2+2NaOH=NaCl+NaClO+H2O可知,标准状况下,22.4 L氯气与足量氢氧化钠溶液反应转移的电子数为NA,D不正确。
本题难度:一般
3、选择题 下列说法中正确的是
A.将322 g Na2SO4·10H2O溶于1 L水中,所得溶液的物质的量浓度为1 mol/L
B.将1 L 2 mol/L H2SO4溶液加水稀释到2 L,所得溶液的物质的量浓度为1 mol/L
C.将1 L 18.4 mol/L的H2SO4溶液加入到1 L水中,所得溶液的物质的量浓度为9.2 mol/L
D.将336 mL HCl气体溶于水,配成300 mL溶液,所得溶液的物质的量浓度为0.05 mol/L
参考答案:B
本题解析:A不正确,应该是溶液的体积为1L;C不正确,应该是稀释后的溶液体积是2L;D不正确,因为气体不一定是在标准状况下,所以正确的答案选B。
本题难度:一般
4、填空题 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
| ? | 溶质的物质的量浓度/mol·L-1 | 溶液的密度/g·cm-3 |
| 硫酸 | c1 | ρ1 |
| 氨水 | c2 | ρ2 |
 c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________
c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________ c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。参考答案:(1) (2)c1/2 (3)大于 大于
(2)c1/2 (3)大于 大于
本题解析:解答本题应注意以下三点:
(1)设硫酸体积为1 L进行计算;
(2)注意加水稀释后,可认为是两溶液的体积和;
(3)由图像可知,硫酸的密度逐渐减小,氨水的密度逐渐增大。
本题难度:一般
5、选择题 若NA表示阿伏加德罗常数的值,下列叙述正确的是
①标准状况下,2.24 L四氯化碳含碳原子数为0.1NA
②标准状况下,a L的氧气和氮气的混合物含有的分子数为a/22.4 NA
③电解精炼铜时,若阴极得到电子数为2NA个,则阳极质量减少64 g
④7 g CnH2n中含有的氢原子数为2NA
⑤常温下,7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.1NA
⑥1 L 2 mol·L-1 ?FeCl3溶液中含Fe3+数为2NA
⑦2 L1 mol·L-1的盐酸中所含氯化氢分子数为2NA
A.①④⑦
B.②⑥
C.③④⑤
D.②⑤
参考答案:D
本题解析:标准状况下,四氯化碳不是气体,不能适用于气体摩尔体积,①不正确;由于粗铜中含有杂质,所以最初失去电子的是活泼的就是锌、铁等,因此阴极得到电子数为2NA个,则阳极质量减少不是64 g,③不正确;CnH2n的最简式是CH2,所以7g中含有的氢原子是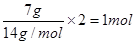 ,④不正确;⑥不正确,因为铁离子水解生成氢氧化铁,所以溶液中含有的铁离子小于2mol;氯化氢是强电解质,在溶液中不存在氯化氢分子,⑦不正确,答案选D。
,④不正确;⑥不正确,因为铁离子水解生成氢氧化铁,所以溶液中含有的铁离子小于2mol;氯化氢是强电解质,在溶液中不存在氯化氢分子,⑦不正确,答案选D。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学必备知识点《溶液的性质.. | |