1、选择题 一定温度下,可逆反应2NO2(g)? ?2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是? ( )
?2NO(g)+O2(g)在体积固定的密闭容器中反应,达到平衡状态的标志是? ( )
①单位时间内生成n mol O2,同时生成2n mol NO2
②单位时间内生成n mol O2,同时生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1
④混合气体的压强不再改变
⑤混合气体的颜色不再改变
⑥混合气体的平均相对分子质量不再改变
A.①④⑤⑥
B.①②③⑤
C.②③④⑥
D.以上全部
参考答案:A
本题解析:①生成n mol O2,就是消耗2n mol NO2,即生成NO2的速率等于消耗NO2的速率,能表示v正=v逆,正确。②表示同一方向的反应速率,不能表示v正=v逆,不正确。③只要发生反应,或者说不论反应是否达到平衡,NO2、NO、O2的速率之比就为2∶2∶1,它不能反映可逆反应是否达到平衡,不正确。④温度、体积一定,混合气体压强不再改变,对于反应前后气体体积不相等的反应,说明气体的总物质的量不变,表明已达平衡。⑤颜色的深浅决定于有色物质NO2的浓度,混合气体颜色不变,说明NO2的浓度不再改变,能说明已达到平衡,正确。⑥混合气体的平均相对分子质量(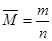 ?)不变,说明气体的总物质的量(n)不变,表明已达平衡,正确。
?)不变,说明气体的总物质的量(n)不变,表明已达平衡,正确。
本题难度:一般
2、选择题 工业上制备高纯硅反应的热化学方程式如下SiCl4(g)+2H2(g)==Si(s)+4HCl(g) △H = +Q kJ/mol(Q>0) 某温度、压强下,将一定量反应物通入密闭容器进行以上反应(此条件下为可逆反应),下列叙述中正确的是
[? ]
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol/L,则H2的反应速率为0.03 mol/(L·min)
D.当反应吸收热量为0.025Q kJ时,生成的HCl通入100 mL 1 mol/L的NaOH溶液恰好反应
参考答案:D
本题解析:
本题难度:一般
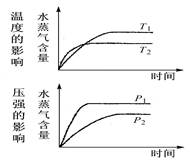
3、选择题 一定条件下,水蒸气含量随反应时间的变化趋势符合下图的是(? )
A.CO2(g)+2NH3( g) CO(NH2)2(s)+H2O(g); △H<0
CO(NH2)2(s)+H2O(g); △H<0
B.CO2(g)+ H2(g)  CO(g)+H2O(g); △H>0
CO(g)+H2O(g); △H>0
C.CH3CH2OH CH2=CH2(g)+ H2O(g); △H>0
CH2=CH2(g)+ H2O(g); △H>0
D.2C6H5CH2CH3(g)+O2(g) 2C6H-5CH=CH2(g)+2H2O(g); △H<0
2C6H-5CH=CH2(g)+2H2O(g); △H<0
参考答案:A
本题解析:根据题给图像知,温度为T2时反应先达到平衡,温度越高,反应速率越快,到达平衡的时间就越短,T2>T1,温度为T2时,反应达平衡时水蒸气的含量降低,则升高温度,平衡向逆反应方向移动,逆反应为吸热反应,正反应为放热反应,△H<0;压强为P1时反应先达到平衡,压强越大,反应速率越快,到达平衡的时间就越短,P1>P2,压强为P1时,反应达平衡时水蒸气的含量升高,则增大压强,平衡向正反应方向移动,则正反应为气体物质系数减小的反应。分析题给选项,选A。
本题难度:简单
4、选择题 汽车尾气净化中的一个反应如下:2NO(g)+2CO(g) N2(g)+2CO2(g)ΔH=-746.8 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,当改变其中一个条件X,Y随X的变化,符合图中曲线的是(? )
N2(g)+2CO2(g)ΔH=-746.8 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,当改变其中一个条件X,Y随X的变化,符合图中曲线的是(? )
A.当X表示温度时,Y表示平衡常数K
B.当X表示温度时,Y表示CO的转化率
C.当X表示N2的物质的量时,Y表示NO的转化率
D.当X表示NO的物质的量时,Y表示平衡常数K
参考答案:D
本题解析:化学平衡常数只与温度有关,该反应的正反应为放热反应,升高温度,平衡常数减小,A错;NO的物质的量的多少对平衡常数没有影响,D对;升高温度,平衡向逆反应方向移动,CO的转化率减小,B错;增加N2的物质的量,平衡向逆反应方向移动,NO的转化率减小,C错
本题难度:一般
5、选择题 ?一定温度下,在体积一定的密闭容器中进行的可逆反应:C(s) + CO2(g) 2CO(g) ,
2CO(g) , 不能判断反应已经达到化学平衡状态的是
不能判断反应已经达到化学平衡状态的是
A.v(CO2)= v(CO)
B.容器中总压强不变
C.容器中混合气体的密度不变
D.容器中CO的体积分数不变
参考答案:A
本题解析:略
本题难度:一般