1、选择题 由乙烯和乙醇蒸气组成的混和气体中,若碳元素的质量百分含量为60%,则氧元素的质量百分含量为( )
A.15.6%
B.26.7%
C.30%
D.无法确定
参考答案:乙烯的分子式为C2H4,乙醇的分子式为C2H6O,可将乙醇的分子式看作C2H4?H2O,
已知:ω(C)=60%,则ω(C2H4)=60%×2824=70%,
则ω(H2O)=1-70%=30%,
所以:ω(O)=30%×1618=26.7%,
故选B.
本题解析:
本题难度:简单
2、选择题 设 为阿伏加德罗常数,下列说法正确的是
为阿伏加德罗常数,下列说法正确的是
A. 时,1g水中约含有6.02×1013个OH-
时,1g水中约含有6.02×1013个OH-
B.在 参与的反应中,
参与的反应中,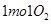 作氧化剂时得到的电子数一定是
作氧化剂时得到的电子数一定是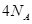
C.1.8g重水(D2O)中含NA个质子和NA个中子
D.标准状况下的22.4L辛烷完全燃烧,生成二氧化碳分子数为8NA
参考答案:A
本题解析:A、水为中性,C(OH?)=1×10-7mol?L?1, 1g水为0.001L,含OH?:0.001L×1×10-7mol?L?1×6.02×1023=6.02×1013,正确;B、1molO2与Na在加热条件下反应生成Na2O2,得电子数为2NA,错误;C、1.8g重水(D2O)中含质子:1.8g÷20g/mol×10 ×NA,错误;D、辛烷在标准状况下为液体,不能用22.4L/mol,错误。
本题难度:一般
3、填空题 实验室用固体烧碱配制500mL0.1000mol/L的NaOH溶液.

(1)需称量______g烧碱
(2)配制过程中,不需要的仪器(填写代号)______
a、烧杯?b、托盘天平?c、玻璃棒?d、1000mL容量瓶?e、漏斗?f、胶头滴管
(3)根据实验需要和(2)所列仪器判断,完成实验还缺少的玻璃仪器有______
(4)步骤B通常称为转移,步骤A通常称为______
(5)将上述实验步骤A到F按实验过程先后次序排列______
(6)若实验时遇到下列情况,将使溶液的浓度偏低的是______.
A、忘记将洗涤液转入容量瓶;
B、容量瓶洗涤后底部内壁有水珠而未作干燥处理;
C、定容、摇匀、静置后发现凹面低于刻度线又加水至刻度线;
D、定容时俯视刻度线.
参考答案:(1)实验室配制0.1mol?L-1的NaOH溶液500mL需要NaOH的质量为:0.5L×0.1mol/L×40g/mol=2.0g,故答案为:2.0g;
(2)配制顺序是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,一般用天平称量(用到药匙)称量,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,塞好瓶塞,反复上下颠倒摇匀.所以需要的仪器有托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,配制过程中,不需要的仪器为1000mL容量瓶、漏斗,
故答案为:d、e;
(3)根据(2)可知,还缺少的仪器为药匙、500 mL容量瓶,故答案为:500 mL容量瓶;
(4)因当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,该步骤操作为定容,所以操作A为定容,故答案为:定容;
(5)配制顺序是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签,所以将上述实验步骤A到F按实验过程先后次序排列为c-b-d-f-a-e,故答案为:c-b-d-f-a-e;
(6)A、因洗涤液中含有溶质,忘记将洗涤液转入容量瓶,溶质的质量减少,浓度减少,故A正确;
B、容量瓶洗涤后底部内壁有水珠而未作干燥处理,对溶液的体积无影响,浓度不变,故B错误;
C、定容、摇匀、静置后发现凹面低于刻度线又加水至刻度线,过会儿滞留在刻度线以上溶液会下落,体积变大,浓度减小,故C正确;
D、定容时俯视刻度线,溶液的液面低于刻度线,溶液的体积偏小,浓度偏大,故D错误;
故答案为:AC.
本题解析:
本题难度:一般
4、选择题 在无土栽培中,需配制1L含0.50mol?L-1的NH4Cl、0.16mol?L-1KCl、0.24mol?L-1K2SO4的混合溶液,但当时没有K2SO4固体,若用(NH4)2SO4固体代替,需用KCl、NH4Cl、(NH4)2SO4三种固体的物质的量(单位为mol)分别为( )
A.0.40、0.50、0.12
B.0.66、0.50、0.24
C.0.64、0.50、0.24
D.0.64、0.02、0.24
参考答案:1L混合液中,n(NH4Cl)=1L×0.5mol/L=0.5mol、n(KCl)=1L×0.16mol/L=0.16mol、n(K2SO4)=1L×0.24mol/L=0.24mol,
故n( Cl-)=n(NH4Cl)+n(KCl)=0.5mol+0.16mol=0.66mol;
n( K+)=n(KCl)+2n(K2SO4)=0.16mol+2×0.24mol=0.64mol;
n(SO42-)=n(K2SO4)=0.24mol;
用KCl、NH4Cl、(NH4)2SO4配制,则:
n[(NH4)2SO4]=n(SO42-)=0.24mol;
n(KCl)=n( K+)=0.64mol;
n(NH4Cl)=n( Cl-)-n(KCl)=0.66mol-0.64mol=0.02mol;
故选D.
本题解析:
本题难度:简单
5、填空题 现用质量分数为98%、密度为1.84g?cm3的浓H2SO4配制500mL、0.2mol?L-1的稀H2SO4.可供选择的仪器有:①玻璃棒?②烧瓶?③烧杯?④胶头滴管?⑤量筒?⑥容量瓶?⑦托盘天平?⑧药匙.请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有______(填代号).
(2)经计算,需浓H2SO4的体积为______.现有①10mL?②50mL?③100mL三种规格的量筒,你选用的量筒是______
(3)将浓H2SO4加适量蒸馏水稀释后,冷却片刻,随后全部转移到______?mL的容量瓶中,转移时应用玻璃棒______.转移完毕,用少量蒸馏水洗涤______2~3次,并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,振荡容量瓶,使溶液混合均匀.然后缓缓地把蒸馏水直接注入容量瓶直到液面接近刻度______处.改用______滴加蒸馏水到瓶颈刻度的地方,使溶液的______.振荡、摇匀后,装瓶、贴签.
(4)在配制过程中,其他操作都准确,下列操作中错误的是______(多选)
①洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓H2SO4直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓H2SO4
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
⑧最后定容后,发现在刻度线的上方粘有一滴H2SO4的浓溶液.
参考答案:(1)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:玻璃棒、烧杯、胶头滴管、量筒、容量瓶,故答案为:②⑦⑧;
(2)设需要98%H2SO4的体积为VmL,根据溶液稀释前后溶质质量不变则,VmL×1.84g/cm3×98%=500mL×0.2mol?L-1×98g/mol,解得V=5.4ml,选用量筒的规格为10mL,
故答案为:5.4ml;10mL;
(3)配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到500mL容量瓶中,并用玻璃棒引流,转移完毕,用少量蒸馏水洗涤烧杯及玻璃棒2~3次并将洗涤液全部转移到容量瓶中,再加适量蒸馏水,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,使溶液的凹液面的最低点与刻线相平,故答案为:500;引流;烧杯及玻璃棒;1-2cm;胶头滴管;凹液面的最低点与刻线相平;
(4)①洗涤量取浓H2SO4后的量筒,不需要将洗涤液转移到容量瓶中,故①错误;
②稀释后的H2SO4溶液应冷却至室温才能转移到容量瓶,故②错误;
③稀释浓H2SO4时,将浓H2SO4沿着烧杯内壁缓慢倒入盛有蒸馏水的烧杯中,故③错误;
④定容时,加蒸馏水超过标线,不能胶头滴管吸出,应重新配制,故④错误;
⑤转移前,容量瓶中含有少量蒸馏水,对实验无影响,故⑤正确;
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线,这样会导致溶液的体积偏大,故⑥错误;
⑦定容时,俯视标线,会使溶液的体积偏小,故⑦错误;
⑧最后定容后,发现在刻度线的上方粘有一滴H2SO4的浓溶液,这样会导致溶液的体积偏大,故⑧错误;
故答案为:①②③④⑥⑦⑧.
本题解析:
本题难度:一般