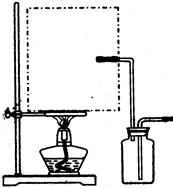
1、实验题 现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O2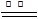 2MgO;②3Mg+N2
2MgO;②3Mg+N2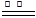 Mg3N2;③2Mg+CO2
Mg3N2;③2Mg+CO2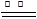 2MgO+C;
2MgO+C;
④Mg+H2O MgO+H2↑; ⑤Mg3N2 +6H2O
MgO+H2↑; ⑤Mg3N2 +6H2O 3Mg(OH)2+2NH3↑
3Mg(OH)2+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
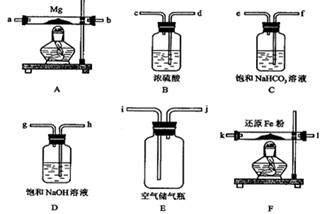
回答下列问题:
(1)在设计实验方案时,除装置A、D、E外,还应选择的装置有?(填字母代号),选择装置D目的为_____________________________?;
(2)通气后,应先点燃?处的酒精灯;如果同时点燃A、F装置的酒精灯,将会使实验结果?(填“偏高”或“偏低”)原因?
(3)请设计一个实验,验证产物是Mg3N2,写出操作步骤、现象和结论:
_____________________________________________________________________?
参考答案:(1)BF?(2分)? D 目的是除去空气中的CO2,避免反应③发生;(2分)
(2)F;(1分)偏低;(2分)如果装置F中的还原铁粉没有达到反应温度时,氧气不能除尽,导致氧同镁反应,而使氮化镁中混入氧化镁。(2分)
(3)取适量产物放入试管中,滴加蒸馏水,将润湿的红色石蕊试纸靠近试管口,如果试管中的溶液出现浑浊,红色石蕊试纸变蓝,则可以证明有氮化镁生成。(2分)
本题解析:(1)该反应中为了得到纯净的氮化镁,必须把影响的产物的气体水,还有氧气去除,装置B是用来除去水蒸汽的,放在A之前,F可以用来除去氧气。D 目的是除去空气中的CO2,避免反应③发生;
(2)这一装置中,很多人可能会考虑到F装置是用来除去水蒸汽的,那样的话,反应产生的氢气怎么办,因此这个装置是用来除去氧气的。如果装置F中的还原铁粉没有达到反应温度时,氧气不能除尽,导致氧同镁反应,而使氮化镁中混入氧化镁。(2分)
(3)验证产物是Mg3N2,必须利用氮化镁的特征反应。取适量产物放入试管中,滴加蒸馏水,将润湿的红色石蕊试纸靠近试管口,如果试管中的溶液出现浑浊,红色石蕊试纸变蓝,则可以证明有氮化镁生成。
本题难度:一般
2、实验题 (9分) 甲酸(HCOOH)是一种有刺激臭味的无色液体,有很强的腐蚀性。熔点8.4℃,沸点100.7℃,能与水、乙醇互溶,加热至160℃即分解成二氧化碳和氢气。
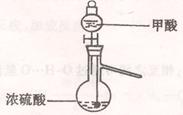
(1)实验室可用甲酸与浓硫酸共热制备一氧化碳:HCOOH浓硫酸========H2O+CO↑,实验的部分装置如下图所示。制备时先加热浓硫酸至80℃—90℃,再逐滴滴入甲酸。
Ⅰ制备CO? Ⅱ? Ⅲ收集CO
①从下图挑选所需的仪器,画出Ⅰ中所缺的气体发生装置(添加必要的塞子、玻璃管、胶皮管,固定装置不用画),并标明容器中的试剂。(2分)
 ?
? ?
? ?
? ?
?
分液漏斗?长颈漏斗?蒸馏烧瓶?集气瓶?温度计
② 装置Ⅱ的作用是?。(2分)
(2)实验室可用甲酸制备甲酸铜。其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸反应制得四水甲酸铜[Cu(HCOO)2·4H2O]晶体。相关的化学方程式是:
2CuSO4+4 NaHCO3= Cu(OH)2·CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2·CuCO3+4HCOOH+ 5H2O="2" Cu(HCOO)2·4H2O+ CO2↑
实验步骤如下:
Ⅰ、碱式碳酸铜的制备:
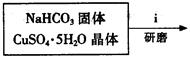


③步骤ⅰ是将一定量CuSO4·5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是?。(2分)
④步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃—80℃,如果看到?(填写实验现象),说明温度过高。(1分)
Ⅱ、甲酸铜的制备:
将Cu(OH)2·CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质。在通风橱中蒸发滤液至原体积的1/3时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2—3次,晾干,得到产品。
⑤“趁热过滤”中,必须“趁热”的原因是?。(1分)
⑥用乙醇洗涤晶体的目的是?。(1分)
参考答案:①用分液漏斗、蒸馏烧瓶、温度计,分液漏斗中盛装甲酸,蒸馏烧瓶中盛装浓硫酸,温度计的水银球应浸入浓硫酸中【仪器选择正确并标识液体,注意温度计水银球的位置】(2分)
②防止水槽中的水因倒吸流入蒸馏烧瓶中(2分)
③研细并混合均匀(1分)
④出现黑色固体(1分)
⑤防止甲酸铜晶体析出(2分)
⑥洗去晶体表面的水和其它杂质(1分)
本题解析:①因为是给液体加热制备气体,且要控制温度,故气体发生装置与实验室制乙烯的发生装置一样,即如上图所示;②因为是用排水法收集气体,故如果受热不均匀就有可能发生倒吸,故Ⅱ为防倒吸装置;③因为是取混和固体多次加入热水中,故两种固体要混合均匀,而NaHCO3固体和CuSO4·H2O晶体均易结成块,故要研细才可混和均匀;④氢氧化铜和碳酸铜受热均不稳定易分解,前者生成黑色的氧化铜和水,后者者黑色的氧化铜和二氧化碳,所以温度过高会使它们分解,出现黑色固体;⑤蒸发浓缩后甲酸铜的浓度比较高,如果冷却至常温会以晶体的形式析出,故要“趁热”过滤;⑥将滤液冷却结晶后,析出的晶体表面一定会残留有溶液中的其它物质,如表面上有水,还有一些其它的溶质都有可能残留在上面,故用乙醇洗涤晶体的目的是洗去晶体表面的水和其它杂质。用乙醇可减少晶体的损失。
本题难度:简单
3、实验题 钴(Co)的氧化物是一种重要的化工原料,工业上利用CoCO3+O2→CoxOy+ CO2反应来生产相应的钴的氧化物。实验室中可以用下列装置来制取钴的氧化物并测定其分子组成。
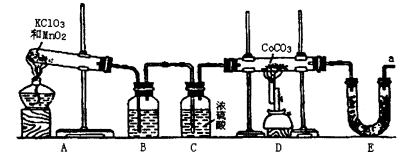
请填写下列空白:
(1)写出A装置的大试管里发生反应的化学方程式?;
(2)E装置的U形管里盛放的物质是?;
A.P2O5?B.无水CaCl2?C.碱石灰?D.无水CuSO4
(3)O3的氧化性比O2强。已知制得的O2中含有少量的Cl2和O3,则B装置中所盛放的物质是?
A.NaOH溶液? B.饱和NaHCO3溶液? C.饱和NaCI溶液 ?D.KI溶液
(4)实验结束时,若先撤去A装置中的酒精灯,会引起?;
(5)在CoCO3完全转化为CoxOy后,若称得E管增重4.40g,D管内残留物质的质量是8.30g,则生成CoxOy的化学式为?;
(6)此实验装置存在一个比较大的缺陷,如何完善?。
参考答案:(1) 2KClO3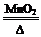 2KCl+3O2↑
2KCl+3O2↑
(2)C (2分)?(3)D (2分) (4) 倒吸(2分,详细写给分)
(5)Co2O3(3分)?(6)在a处接一装有碱石灰的干燥管(2分,干燥剂若不能吸收CO2不给分)
本题解析:由装置图可知,实验通过测定装置E中的增重,确定生成的二氧化碳的质量,再利用n(C)=n(Co)可知CoxOy中Co的物质的量,进而计算Co的质量。装置D管内残留物质是CoxOy,计算出氧元素质量,再计算氧原子的物质的量,根据原子物质的量之比确定化学式。
(1)在二氧化锰作催化剂,加热条件下,氯酸钾分解生成氯化钾、氧气,反应的化学方程式为2KClO3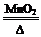 2KCl+3O2↑。
2KCl+3O2↑。
(2)E装置的U形管里盛放的物质用于吸收装置D生成的二氧化碳。A、P2O5;B、无水CaCl2;D、无水CuSO4均不能吸收二氧化碳。C、碱石灰是碱性干燥剂,可以吸收二氧化碳,故装置E中试剂为碱石灰,所以答案选C。
(3)制得的O2中含有少量的Cl2和O3,B装置中所盛放的物质用于吸收Cl2和臭氧。A、NaOH溶液可以吸收氯气,但不能吸收臭氧,所以A不正确;B、饱和NaHCO3溶液以吸收氯气,但生成二氧化碳,影响二氧化碳质量的测定,且不能吸收臭氧,故B不符合;C、饱和NaCl溶液不能吸收氯气和臭氧,故C错误;D、KI溶液吸收氯气和臭氧,所以D符合,答案选D。
(4)实验结束时,若先撤去A装置中的酒精灯,会导致装置A中的压强降低,容易发生倒吸。
(5)E管增重4.40g是二氧化碳的质量,物质的量为4.40g÷44g/mol=0.1mol。根据化学式CoCO3可知n(Co)=n(C)=0.1mol,则Co的质量为0.1mol×59g/mol=5.9g。D管内残留物质的质量8.30g是CoxOy的质量,CoxOy中氧元素质量为8.30g-5.9g=2.4g,氧原子的物质的量n(O)=2.4g÷16/mol=0.15mol,所以n(Co):n(C)=0.1mol:0.15mol=2:3,即该钴的氧化物的化学式为Co2O3。
(6)由于装置E中碱石灰也可以吸收空气中水蒸气、二氧化碳,影响二氧化碳质量的测定,因此应在a处接一装有碱石灰的干燥管,吸收空气中水蒸气、二氧化碳,防止进入装置E中。
本题难度:一般
4、实验题 (共12分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。实验室可以用装置F制备氯气,反应的化学方程式为:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
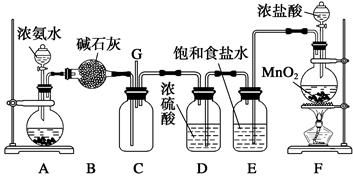
请回答下列问题:
(1)、装置F中发生反应的离子方程式为_______________________________________;
(2)、为了快速制备氨气,装置A的烧瓶中可装试剂_____________________;
(3)、B装置的名称是_____________;(填符号)? A.洗气瓶? B.干燥管? C.分液漏斗
E装置的作用是__________________________________________________________;
(4)通入C装置的两根导管左边较长、右边较短,目的是________________________;
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出反应的化学方程式:_________________________________________________。
(6)从装置C的G处逸出的尾气中可能含有黄绿色的有毒气体,如何处理?____________________________________________________________________________。
参考答案:(1)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O(2分)
(2).CaO或.NaOH(1分)
(3) B,(1分)?除去氯气中的氯化氢(2分)
(4)使密度大的氯气与密度小的氨气较快地均匀混合(2分)
(5)3Cl2+8NH3===N2+6NH4Cl(2分)
(6)在G连接导管直接通入盛有烧碱的烧杯中(2分)
本题解析:(1)F是来制取氯气的,方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O。
(2)氨水具有挥发性浓度越大越易挥发,且气体的溶解度随温度的升高而降低,所以可以将氨水滴入生石灰或氢氧化钠固体中。
(3)根据B装置特点可判断,该仪器是干燥管。制取的氯气中含有氯化氢气体,所以需要利用饱和石灰水来除去杂质氯化氢。
(4)氨气的密度小于空气的,氯气的密度大于空气的,所以这样做的目的是为了使气体充分混合。
(5)氯气具有强氧化性,能氧化氨气,根据实验现象可判断生成物是氮气和氯化铵,方程式为3Cl2+8NH3===N2+6NH4Cl。
(6)氯气有毒,需要尾气处理。可以利用碱液来吸收多余的氯气。
本题难度:一般
5、实验题 配制500mL 1.0mol·L—1的NaOH溶液时,下列哪些操作会使实验结果偏高_____________;偏低__________;无影响______________。
A.称量时,直接把氢氧化钠放在纸上称量,且称量时间过长
B.称量时,固体放在右盘,砝码放在左盘
C.称量时所用砝码生锈
D.原容量瓶用蒸馏水洗净后未干燥