1、选择题 下列电离方程式中,正确的是
A.Al2(SO4)3=2Al+3+3SO4-2
B.CuCl2=Cu2++2Cl-
C.K2SO4=2K++S6++4O2-
D.Na2CO3=Na++CO
参考答案:B
本题解析:分析:A、硫酸铝是强电解质溶液中完全电离生成离子,标注离子所带电荷错误;
B、氯化铜是溶于水的强电解质完全电离生成铜离子和氯离子;
C、硫酸钾溶液中电离生成硫酸根离子和钾离子;
D、碳酸钠溶液中电离生成钠离子和碳酸根离子,注意电荷守恒.
解答:A、硫酸铝是强电解质溶液中完全电离,电离方程式为:Al2(SO4)3=2Al3++3SO42-,故A错误;
B、氯化铜是溶于水的强电解质完全电离生成铜离子和氯离子,电离方程式为:CuCl2=Cu2++2Cl-,故B正确;
C、硫酸钾溶液中电离生成硫酸根离子和钾离子,电离方程式为:K2SO4=2K++SO42-,故C错误;
D、碳酸钠溶液中电离生成钠离子和碳酸根离子,电离方程式为:Na2CO3=2Na++CO32-,故D错误;
故选B.
点评:本题考查了电离方程式的正误判断和书写方法,注意物质溶解性分析,离子符号书写,电离生成离子的判断,题目较简单.
本题难度:困难
2、选择题 部分弱酸的电离平衡常数如下表:
弱酸
| HCOOH
| HCN
| H2CO3
|
电离平衡常数(25℃)
| Ki=1.77×10-4
| Ki=4.9×10-10
| Ki1=4.3×10-7
Ki2=5.6×10-11
|
下列选项错误的是( )
①2CN-+H2O+CO2=2HCN+CO32-
②2HCOOH+CO32-=2HCOO-+H2O+CO2↑
③中和等体积、等pH的HCOOH和HCN,消耗NaOH的量前者小于后者
④等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
A.①② B.②③ C.③④ D.①④
参考答案:D
本题解析:根据电离常数可知酸性HCOOH>H2CO3>HCN>HCO3-,A错误,B正确;等体积、等pH的HCOOH和HCN溶液所含溶质HCN溶液更多,则中和时消耗的NaOH的量多,C正确;根据电荷守恒,n(HCOO-)+n(OH-)=n(Na+)+n(H+),n(CN-)+n(OH-)=n(Na+)+n(H+),即离子总数是n(Na+)+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的n(OH-)大,n(H+)小,D错误。
本题难度:一般
3、填空题 (8分)
I.已知在25℃时,HF、HCN和H2CO3的的电离平衡常数如表所示:
(1)写出碳酸的第一级电离平衡常数表达式:K1= 。
(2)①往Na2CO3溶液中加入足量HF溶液,发生反应的离子方程式:
②往NaCN溶液中通入少量CO2,发生反应的离子方程式:
II. 用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是 。
参考答案:)I. (1)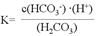 (2分)
(2分)
(2)①2HF+CO32-=2F-+H2O+CO2↑ (2分)②CN-+H2O+CO2= HCN+HCO3- (2分)
II. 在干燥的HCl气流中,抑制了MgCl2的水解,且带走了MgCl2·6H2O受热产生的水蒸气。(2分)
本题解析:(1)碳酸是二元弱酸,分别电离,碳酸的第一级电离平衡常数表达式: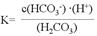 ;(2)①由于酸性HF>H2CO3,所以往Na2CO3溶液中加入足量HF溶液,发生反应的离子方程式2HF+CO32-=2F-+H2O+CO2↑;②由于酸性:H2CO3> HCN> HCO3- ,往NaCN溶液中通入少量CO2,发生反应的离子方程式是CN-+H2O+CO2= HCN+HCO3-;II. 用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是在干燥的HCl气流中,抑制了MgCl2的水解,且带走了MgCl2·6H2O受热产生的水蒸气,从而得到无水MgCl2。
;(2)①由于酸性HF>H2CO3,所以往Na2CO3溶液中加入足量HF溶液,发生反应的离子方程式2HF+CO32-=2F-+H2O+CO2↑;②由于酸性:H2CO3> HCN> HCO3- ,往NaCN溶液中通入少量CO2,发生反应的离子方程式是CN-+H2O+CO2= HCN+HCO3-;II. 用电解法制取金属镁时,需要无水氯化镁。在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是在干燥的HCl气流中,抑制了MgCl2的水解,且带走了MgCl2·6H2O受热产生的水蒸气,从而得到无水MgCl2。
考点:考查弱酸的电离平衡常数的应用、离子方程式的书写及盐的水解对物质制取条件的影响的知识。
本题难度:一般
4、简答题 某二元酸H2A电离方程式是:H2A=H++HA-,HA-?A2-+H+.回答下列问题:
(1)Na2A溶液显______性,理由是(用离子方程式表示)______.
(2)若0.1mol/LNaHA溶液的pH=2,则0.1mol/LH2A溶液中氢离子的物质的量浓度可能______0.11mol/L(填“<”、“>”或“=”)理由是______.
(3)某温度下,向10mL、0.1mol/LNaHA溶液中加入0.1mol/LKOH溶液VmL至中性,此时溶液中以下关系一定正确的是______(填写字母).
A.溶液pH=7 B.水的离子积KW=c2(OH-)
C.V=10D.c(K+)<c(Na+)
(4)0.1mol/LNaHA溶液中各离子浓度由大到小的顺序是______.
参考答案:(1)根据H2A的电离是分步电离可以知道H2A是弱酸,所以Na2A溶液显碱性,水解原理是:H2O+A2-?HA-+OH-,故答案为:碱性;H2O+A2-?HA-+OH-;
(2)0.1mol?L-1H2A溶液,H2A═H++HA-,电离出0.1mol/LH+,0.1mol?L-1NaHA溶液的pH=2,则由HA-?H++A2-可知,电离出0.01mol/LH+,但第一步电离生成的H+抑制了HA-的电离,所以溶液中氢离子的物质的量浓度小于0.1mol/L+0.01mol/L,
故答案为:<;H2A第一步电离生成的H+抑制了HA-的电离;
(3)A.由于温度不知道,故中性时溶液pH不能确定,故A错误;
B.中性c(OH-)=c(H+),Kw=c(OH-)c(H+)=KW=c2(OH-),故B正确;
C.HA-与 OH-恰好反应时生成A2-,溶液呈碱性,已知溶液为中性,说明NaHA溶液有剩余,故V<10,故C错误
D.根据C选项判断,NaHA过量,所以c(K+)<c(Na+),故D正确.
故答案为:BD.
(4)NaHA溶液显酸性,存在HA-?H++A2-,则c(Na+)>c(HA-)>c(H+)>c(OH-),结合水的电离H2O?H++OH-,同时有部分A2-发生水解,使c(A2-)减小,所以c(H+)>c(A2-),即NaHA溶液中各种离子浓度由大到小的顺序为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故答案为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-).
本题解析:
本题难度:一般
5、填空题 化合物SOCl2是一种液态化合物,沸点为77℃。在盛10ml水的锥形瓶中小心滴加8-10滴SOCl2可观察到剧烈反应,液面上形成白雾,并有刺激性气味的气体放出,该气体可使湿润的品红试纸褪色。在反应后的溶液中滴加AgNO3溶液,可生成一种不溶于稀HNO3的白色沉淀。
(1)试据上述实验事实,写出SOCl2与水反应的化学方程式 。
(2)将ZnCl2溶液蒸发至干,得不到无水ZnCl2,工业上常用ZnCl2?2H2O与SOCl2共热制取ZnCl2。试结合离子方程式解释原因: 。
(3)科学家经常利用 水解原理制备纳米材料,请写出用TiCl4制备TiO2·xH2O的化学方程式: 。
水解原理制备纳米材料,请写出用TiCl4制备TiO2·xH2O的化学方程式: 。
参考答案:
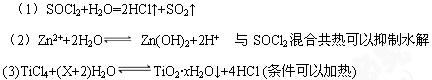
本题解析:略
本题难度:困难