|
高考化学知识点归纳《有关氧化还原反应的计算》试题巩固(2017年最新版)(四)
2018-03-17 06:48:36
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、计算题 (6分)已知反应CuS +4HNO3=Cu(NO3)2 +2NO2↑+S↓+2H2O,当电子转移电子数为1.806×1023时,被还原的硝酸的物质的量是?,氧化产物的质量是?,产生标况NO2的体积为?。
参考答案:? 0.3mol?,? 4.8g?,? 6.72L?
本题解析:略
本题难度:一般
2、选择题 将9.0g铜和铁的混合物投入100 ml稀硝酸中,充分反应后得到标准状况下1.12L NO,剩余4.8g金属;继续加入100 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下l.12L NO。若向反应后的溶液中滴入KSCN溶液,溶液不变红。则下列说法正确的是
A.第一次与100 mL稀硝酸反应后剩余4.8g金属为铜和铁
B.反应前稀硝酸的物质的量浓度无法计算
C.若向上述最后所得溶液中再加入足量的稀硝酸,还可得到标准状况下1.12L NO
D.原混合物中铜和铁的物质的量各为0.075 mol
|
参考答案:D
本题解析:两次反应后,向反应后的溶液中滴入KSCN溶液,溶液不变红,说明铁全部生成Fe3+,生成NO共0.1mol,则溶液中的溶液中溶质为Cu(NO3)2、Fe(NO3)2,则由原子守恒得:
n(Cu)×64g/mol+n(Fe)×56g/mol=9.0g
由电子守恒可得:
2×[n(Cu)+n(Fe)]=0.1mol×3
解得:n(Cu)=n(Fe)=0.075mol,故D正确。
A、因n(Fe)=0.075mol质量为4.2g,当铁完全反应时剩余4.8g全为铜。不可能为铁与铜的混合物。故A不错误。
B、由N原子守恒可知n(HNO3)=0.1mol+2×[n(Cu)+n(Fe)]=0.4mol,c(HNO3)=0.4mol/0.2L=2mol/L,故B错误。
C、再加足量稀硝酸,溶液中的Fe2+继续发生氧化还原反应放出NO,由电荷守恒1×n(Fe2+)=3×n(NO),得n(NO)=0.025mol,体积为0.56L。故C错误。
考点:了解金属与硝酸的反应,并能进行简单计算。
点评:本题考查离子晶体配位数的影响因素(几何因素、电荷因素等),晶格能对晶体性质的影响,碳酸盐热分解温度的规律等。
本题难度:一般
3、选择题 已知粗碘中含有的IBr和ICl受热都会升华,若先在粗碘中加入下列物质中的一种再加热,就可制得纯净的碘。该物质是
A.KI
B.H2O
C.Zn
D.NaCl
参考答案:A
本题解析:利用碘易升华的特性精制碘,须使ICl、IBr中的Cl、Br变为难挥发性的物质,而使其中的+1价的碘被还原为I2,同时加入的物质和碘(I2)不反应。A、加入KI发生:反应为IBr+KI=I2+KBr,ICl+KI=I2+KCl,加热时I2升华与KCl、KBr分离,故A正确;B、加入水,导致碘难以升华,且水中溶解部分碘,不符合分离、提纯的目的,故B错误;C、加入Zn,在加热条件下生成ZnI,影响被提纯的物质,不符合提出的原则,故C错误;D、加入NaCl与杂质不反应,不能起到除杂的目的,故D错误,答案选A。
本题难度:简单
4、填空题 2014年全运会在辽宁举办,其开幕式就是一场焰火盛宴。
(1)焰火利用了部分金属元素特征的?反应,该反应属于?(填“物理”或“化学”)变化。
(2)如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素组成,每种化合物仅含两种元素。
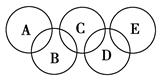
图中A是沼气的主要成分,B、E分子中所含电子数均为18,B不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E分子结构的球棍模型为 ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题: ,C与纯碱在高温下的反应是工业制玻璃的主要反应之一,D中所含两种元素的原子个数比为3∶4,电子总数之比为3∶2。根据以上信息回答下列问题:
①B的水溶液呈弱酸性,其主要的电离方程式可表示为?,D的化学式是?。
②A、B、E中均含有的一种元素符号为?。
③C与纯碱反应的化学方程式为?。
④液态B与液态E反应可生成一种单质和一种常见液体,1 mol B参加反应放出热量Q kJ,其反应的热化学方程式为?。
参考答案:(1)焰色 物理
(2)①H2O2?HO2-+H+ Si3N4 ②H
③SiO2+Na2CO3 Na2SiO3+CO2↑ Na2SiO3+CO2↑
④N2H4(l)+2H2O2(l)=N2(g)+4H2O(l) ΔH=-2Q kJ·mol-1
本题解析:根据题意,A为CH4,B为H2O2,C为SiO2;由E分子结构的球棍模型和N、H元素的价键规则知,大黑球表示N原子,小黑球表示H原子,故E为N2H4。D中所含Si和N两种元素,且原子个数比为3∶4,电子总数之比为3∶2,故化学式为Si3N4。
本题难度:简单
5、选择题 在反应:KClO3 + 6HCl= 3Cl2↑+KCl + 3H2O中,被氧化与被还原的氯原子数之比
A.1:6
B.1:5
C.5:1
D.6:1
|