1、选择题 某溶液中有Fe3+、Mg2+、Fe2+和Al3+四种阳离子,若向其中加入过量的氢氧化钠溶液,搅拌后,再加入过量的盐酸,溶液中大量减少的阳离子是
A.Fe2+
B.Mg2+
C.Fe3+
D.Al3+
参考答案:A
本题解析:略
本题难度:简单
2、选择题 常温下,下列各组离子在所给条件下能够大量共存的是( )
A.酸性环境下的无色透明溶液中:Na+、Cu2+、NO 、SO
、SO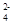
B.c(H+)=10-14mol·L-1的溶液中:Na+、AlO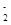 、S2-、SO
、S2-、SO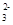
C.能与金属铝反应放出氢气的溶液:Fe2+、SO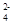 、NO
、NO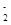 、Na+
、Na+
D.使pH试纸显红色的溶液中:Cu2+、Fe3+、NO 、SO
、SO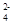
参考答案:B D
本题解析:A.Cu2+在溶液中显蓝色,不能存在于透明溶液中,该项不符合;
B.c(H+)=10-14mol·L-1的溶液显碱性,可以大量存在Na+、AlO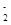 、S2-、SO
、S2-、SO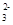 ,该项符合;
,该项符合;
C.溶液显酸性或碱性,酸性时NO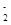 不能大量存在,碱性时Fe2+不能大量存在,该项不符;
不能大量存在,碱性时Fe2+不能大量存在,该项不符;
D.使pH试纸显红色的溶液显酸性,可以大量存在:Cu2+、Fe3+、NO 、SO
、SO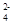 ,该项符合。故本题选BD。
,该项符合。故本题选BD。
点评:本题考查离子共存问题,题目难度不大。看离子间是否发生反应,若在溶液中发生反应,就不能共存。注意看能否发生反应,不仅是因为有沉 淀、气体、水、难电离的物质产生,还涉及到溶液酸碱性、有色、无色,能否进行氧化还原反应等。
本题难度:简单
3、填空题 (14分)某化学兴趣小组在课外活动中,对某溶液进行了多次检测,其中三次检测结果如下表所示,请回答:
检测次数
| 溶液中检测出的物质
|
第一次
| KCl、K2SO4、Na2CO3、NaCl
|
第二次
| KCl、BaCl2、Na2SO4、K2CO3
|
第三次
| Na2SO4、KCl、K2CO3、NaCl
|
(1)三次检测结果中第 次检测结果不正确。
(2)检测时,为了确定溶液中是否存在SO42-和CO32-:
第一,向溶液滴加 溶液(填化学式),其目的是 。
第二,继续加入过量的该溶液,其目的是 。
第三,再向溶液中加入 溶液(填化学式),确定 离子的存在,其离子反应方程式为 。
参考答案:(14分)(1)二(2)稀HNO3 检验CO32- 除去CO32-
BaCl2 SO42- Ba2+ + SO42- ="=" BaSO4↓
本题解析:(1)因氯化钡与硫酸钠在同一溶液中不共存,所以第二次检测结果不正确;
(2)为了确定溶液中是否存在硫酸根离子、碳酸根离子,必须在确定硫酸根离子时,先排除碳酸根离子的干扰,所以我们首先检验并除去碳酸根离子,第一,向溶液滴加稀硝酸,其目的是检验碳酸根离子,第二,继续加入过量的稀硝酸,其目的是除去碳酸根离子,第三,再向溶液中加入氯化钡溶液,确定硫酸根离子的存在,其离子反应方程式为 Ba2+ + SO42- ="=" BaSO4↓.
考点:考查离子的检验。
本题难度:一般
4、选择题 下列反应的离子方程式书写正确的是
A.AlCl3溶液中加入足量的氨水:Al3++ 3OH-══ Al(OH)3↓
B.Cl2和H2O反应:Cl2+H2O===2H++Cl—+ClO—
C.盐酸与Na2SiO3溶液:SiO32—+2H+===H2SiO3↓
D.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑
参考答案:C
本题解析:A项氨水不能拆开;B项HClO不能拆开;C正确;D项原子不守恒,反应物中要增加水。
点评:离子方程式的书写中要注意只有强酸、强碱、可溶性盐可以拆开,其余物质均不能拆开。本题属于中等题。
本题难度:一般
5、选择题 在某无色透明的酸性溶液中,能大量共存的离子组是( )
A.Na+ 、K+、SO42-、HCO3-
B.Cu2+、K+、SO42-、NO3-
C.Na+、 K+、Cl-、 NO3-
D.Fe3+、K+、SO42-、Cl-