1、选择题 氨可用于工业制硝酸,其主反应为:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)?ΔH<0若此反应起始的物质的量相同,则下列关系图正确的是
4NO(g)+6H2O(g)?ΔH<0若此反应起始的物质的量相同,则下列关系图正确的是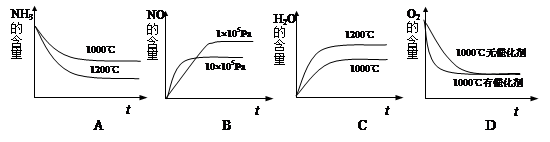
参考答案:BD
本题解析:该反应为放热反应,升高温度,平衡向左移动,NH3的含量增大、水的含量减少,A、C错误;压强越大,反应速率越快,但增大压强,平衡向左移动,NO含量减小,B正确;使用催化剂,反应速率加快,但对化学平衡移动无影响,O2的含量不变,D正确。
点评:分析化学平衡图像先要看清横坐标和纵坐标表示的物理量,然后根据勒沙特列原理分析曲线的变化趋势及位置高低。
本题难度:一般
2、选择题 对于x A(g) + y B(g) 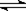 ?z C(g)+ w D(g)的平衡体系,当升高温度时,体系的压强降低,下列说法中正确的是(?)
?z C(g)+ w D(g)的平衡体系,当升高温度时,体系的压强降低,下列说法中正确的是(?)
A.x+y>z+w ,正反应是放热反应
B.x+y>z+w ,正反应是吸热反应
C.x+y<z+w ,逆反应是放热反应
D.x+y>z+w ,逆反应是吸热反应
参考答案:B
本题解析:如果正反应是放热反应,则升高温度,平衡向逆反应方向移动。要使体系的压强降低,则气体的体积应该是减小的,即正反应使体积增大的,所以选项A、D不正确;如果正反应是吸热反应,则升高温度,平衡向正反应方向进行,则正反应一定是体积减小的,选项B正确,C不正确,所以答案选B。
本题难度:一般
3、选择题 可逆反应A(g) + 3B(g)  2C(g);△H < 0。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 molA和3 molB,在一定条件到下达平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2 molC达到平衡后吸收热量为Q2 kJ,已知Q1=3Q2。下列叙述错误的是(?)
2C(g);△H < 0。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 molA和3 molB,在一定条件到下达平衡时放出热量为Q1 kJ;在相同的条件下,向乙容器中加入2 molC达到平衡后吸收热量为Q2 kJ,已知Q1=3Q2。下列叙述错误的是(?)
A.甲中A的转化率为75%
B.甲、乙中C的体积分数相同
C.平衡后再向乙中加入0.25 mol A、0.75 mol B、1.5 mol C,平衡向生成C的方向移动
D.乙中的热化学反应方程式为2C(g) A(g)+3B(g);△H=+3Q2 kJ·mol-1
A(g)+3B(g);△H=+3Q2 kJ·mol-1
参考答案:D
本题解析:略
本题难度:一般
4、选择题 在相同温度和压强下,对反应CO2(g) + H2(g)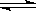 CO(g) + H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表,四种情况达到平衡后,n (CO)的大小顺序是?(?)
CO(g) + H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表,四种情况达到平衡后,n (CO)的大小顺序是?(?)
?
| CO2
| H2
| CO
| H2O
|
甲
| a mol
| a mol
| 0 mol
| 0 mol
|
乙
| 2a mol
| a mol
| 0 mol
| 0 mol
|
丙
| 0 mol
| 0 mol
| a mol
| a mol
|
丁
| a mol
| 0 mol
| a mol
| a mol
|
A.乙=丁>丙=甲? B.乙>丁>甲>丙? C.丁>乙>丙=甲? D.丁>丙>乙>甲
参考答案:A
本题解析:四个容器中若都换算成反应物,则CO2和H2的物质的量(mol)分别为甲:a、a;乙:2a、a;丙:a、a;丁:2a、a。所以甲=丙,乙=丁。乙容器相当于在甲平衡的基础上又加入了amol的CO2,因此可提高氢气的转化率,生成物CO的物质的量就多。故答案是A。
本题难度:一般
5、计算题 某反应,在不同反应时间各物质的量变化情况如图所示。则该反应的反应物(用A、B、C的字母填写)化学方程式为?;
若反应在5L的密闭容器中进行,反应进行到2min时用A表示的化学反应速率为?。2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了?状态。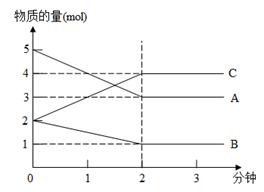
参考答案:2A+B  2C; 0.2mol/(L·min)。化学平衡
2C; 0.2mol/(L·min)。化学平衡
本题解析:根据图像可知A和B是反应物,C是生成物。当反应进行到2min时,A、B、C、D的浓度不再发生变化,说明反应达到化学平衡状态。在2min内A、B、C的物质的量变化量分别为5mol-3mol=2mol、2mol-1mol=1mol、4mol-2mol-2mol,所以方程式为2A+B  2C。用A表示3的反应速率为
2C。用A表示3的反应速率为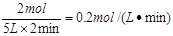 。
。
本题难度:一般