1、填空题 (6分)常温下,将0.1000 mol?L-1 NaOH溶液滴入20.00 mL 0.1000 mol?L-1的一元酸HA溶液中,测得混合溶液的pH变化曲线如下图所示。
(1)HA与NaOH溶液反应的离子方程式是?。
(2)图中②点所示溶液中,下列粒子的浓度关系正确的是?(填序号)。
a.2c(Na+)= c(HA)+c(A-)
b.c(Na+)+c(H+)=c(A-)+c(OH-)
c.c(Na+)>c(A-)>c(H+)>c(OH-)
(3)图中③点所示滴入的NaOH溶液的体积V?20.00 mL(填“>”、“<”或“=”)。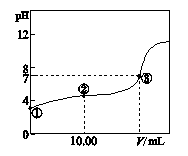
参考答案:(6分)
(1)(2分)HA+OH—=A—+H2O
(2)(2分)ab(漏选得1分,错选不得分)
(3)(2分)<
本题解析:本试题主要考查酸碱中和图像中关于离子浓度大小比较问题,包含中和反应、盐类水解知识的运用。对于此类试题,经常考查的有NaOH~HA弱酸以及氨水~盐酸两类试题。所以,应该记住几个重要的点:起点---可以判断是否是弱电解质或者是起始pH;恰好反应点---酸碱按照化学计量数之比反应,具体的酸碱性取决于盐的水解;恰好中和点----pH=7点;等浓度盐与酸(或碱)点。如果能够将上述的四点分析清楚,此类试题迎刃而解。
(1)据①点可知,此酸为弱酸,所以离子方程式中不进行拆分。
(2)②点为等浓度的HA与NaA混合溶液,此溶液中以HA的电离为主(显酸性),故
c(A-)>c(Na+)>c(H+)>c(OH-),c错误;a为物料守恒,Na原子的各种形式与A原子的各种形式浓度相等,故a正确;b为电荷守恒,正电荷总数=负电荷总数。
(3)图中③点为恰好中和点,如果滴入的NaOH溶液的体积V=20.00 mL时,两者恰好反应,溶液中溶质为NaA,为强碱弱酸盐,显碱性,若要显酸性,则应少加碱,VNaOH<20.00 mL
此试题是一种比较常规的考试题,但是在高考试题中重现率很高,望考生好好分析,并将几种情况一一分析清楚。
本题难度:一般
2、选择题 下列各组离子在溶液中能大量共存的是(?)
①Ca2+、Na+、OH— 、NO3—?②K+、Fe3+ I—、Cl—?③NH4+、Na+、Cl—、CH3COO—
④K+、Mg2+、SO42—、CO32-?⑤Na+、S2—、SO42—、H+?⑥Na+、Cl—、ClO—、SO42—
A.①②③④⑤⑥
B.②⑤
C.②④⑥
D.③⑥
参考答案:D
本题解析:离子在水溶液中能大量共存,根据复分解反应发生的条件,溶液中的离子需要满足以下条件:离子间不能形成沉淀(难溶物)或气体(易挥发物质)或水(难电解物质)。①含有Ca2+、OH— ,Ca(OH)2溶解度小,不能大量存在;②Fe3+ 和I— 会发生氧化还原反应,不能共存;③NH4+和CH3COO—可以共存,因为铵根离子与醋酸根离子的水解程度都很小,两者水解促进(双水解)的程度也小,所以可以共存;④Mg2+和CO32-?可生成MgCO3,MgCO3一般情况下微溶于水,且易与水反应Mg(OH)2沉淀⑤酸性条件下,S2—和SO42—会发生氧化还原反应,不能大量共存;⑥Na+、Cl—、ClO—、SO42—可以大量存在。故③⑥符合题意,故选D。
点评:本题考查离子共存问题,掌握一些常见离子的共存规律则可以快速解决此类问题:H+不能与OH-、CO32-共存,OH-不能与大多数金属离子、NH4+共存,CO32-不能与大多数金属离子、H+共存,SO42-不能与Ba2+、Cl-不能与Ag+共存等。
本题难度:简单
3、选择题 水溶液中能大量共存的一组离子是
A.K+、Ca2+、Cl-、SO42-
B.Fe2+、H+、CO32-、ClO-
C.Mg2+、NH4+、Cl-、SO42-
D.H+、Fe3+、NO3-、SCN-