1、选择题 常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是
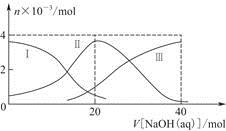
A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系:
c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C.H2A第一步电离的方程式为H2A===HA-+H+
D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小
参考答案:A
本题解析:当V[NaOH(aq)]=20 mL时,c(HA-)>c(A2-)>c(H2A),可知NaHA的电离程度大于其水解程度,溶液显酸性,A项正确;NaHA电离出的H+抑制了水的电离,B项错误;H2A为弱酸,其电离过程是可逆的,C项错误;NaHA溶液在稀释过程中酸性降低,pH升高,D项错误。
本题难度:一般
2、选择题 在由水电离产生的H+浓度为1×10-13mol-L-1的溶液中,一定能大量共存的离子组是( )
①K+、Cl-、NO3-、S2-?②K+、Fe2+、I-、SO42-?③Na+、Cl-、NO3-、SO42-④Na+、Ca2+、Cl-、HCO3-? ⑤K+、Ba2+、Cl-、NO3-.
A.①③
B.③⑤
C.③④
D.②⑤
参考答案:因由水电离产生的H+浓度为1×10-13mol?L-1的溶液,小于1×10-7mol?L-1,水的电离受到抑制,该溶液可能为酸或碱的溶液,
①碱溶液中该组离子不反应,但酸溶液中NO3-、S2-?发生氧化还原反应而不能大量共存,故①错误;
②碱溶液中Fe2+、OH-结合生成沉淀,酸溶液中该组离子不反应,故②错误;
③该组离子在酸或碱溶液中都不发生反应,则一定能大量共存,故③正确;
④酸溶液中HCO3-与H+结合生成二氧化碳和水,碱溶液中HCO3-与OH-结合生成碳酸根离子和水,生成的碳酸根离子与Ca2+结合生成碳酸钙沉淀,则一定不能共存,故④错误;
⑤该组离子在酸或碱溶液中都不发生反应,则一定能大量共存,故⑤正确;
故选B.
本题解析:
本题难度:一般
3、选择题 在下列透明溶液中,因氧化还原反应而不能大量共存的离子组是
A.Na+、K+、H+、S2―
B.Cl—、Al3+、OH―、Na+
C.Na+、CH3COO—、H+、K+
D.K+、I— 、Na+、Fe3+
、Na+、Fe3+
参考答案:D
本题解析:略
本题难度:一般
4、选择题 能在溶液中大量共存、且加入(NH4)2Fe(SO4)2?6H2O晶体后仍能大量存在的离子组是( )
A.Cu2+、S2-、Br-、ClO-
B.K+、Ca2+、OH-、I-
C.K+、H+、Cl-、NO3-
D.Na+、Mg2+、Cl-、SO42-
参考答案:A、因Cu2+、S2-能结合生成沉淀,则不能大量共存,故A错误;
B、因该组离子不反应,则能共存,但加入(NH4)2Fe(SO4)2?6H2O晶体后,OH-、NH4+能结合生成弱电解质,Ca2+、SO42-结合生成微溶物,则不能大量共存,故B错误;
C、因该组离子不反应,则能共存,但加入(NH4)2Fe(SO4)2?6H2O晶体后,Fe2+、H+、NO3-能发生氧化还原反应,则不能大量共存,故C错误;
D、因该组离子不反应,则能共存,加入(NH4)2Fe(SO4)2?6H2O晶体后,离子之间还是不能反应,则仍能大量存在,故D正确;
故选D.
本题解析:
本题难度:简单
5、选择题 下列离子可以大量共存的是( )
A.Al3+、NH4+、NO3-、OH-
B.K+、Ag+、Cl-、NO3-
C.K+、SO42-、Na+、AlO2-
D.Ba2+、Na+、OH-、CO32-
参考答案:A.Al3+、NH4+与OH-发生反应分别生成沉淀、弱电解质而不能大量共存,故A错误;
B.Ag+与Cl-反应生成沉淀而不能大量共存,故B错误;
C.离子之间不发生任何反应,可大量共存,故C正确;
D.Ba2+与CO32-反应生成沉淀而不能大量共存,故D错误.
故选C.
本题解析:
本题难度:一般