1、选择题 下列说法正确的是?
A.Li是最活泼金属,F是最活泼非金属
B.元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16纵行
C.X2+的核外电子数目为18,则X在第四周期第ⅡA族
D.Mg(OH)2碱性比Ca(OH)2强
参考答案:C
本题解析:A选项Fr才是最活泼的金属。故A选项是错误的。B选项在周期表中,有7个横行,7个周期,有18个纵行,16族。因此B选项是错误的。D半径越大,碱性越强,钙的半径比镁的大,因此氢氧化钙的碱性比氢氧化镁的强,所以D选项是错的
本题难度:一般
2、选择题 X、Y、Z是短周期中的三种相邻的元素,X和Y同周期,Y和Z同主族。这三种元素原子的最外层电子数总和是17,核内质子数总和是31,则X、Y、Z三种元素是下列各组中的
A.N、O、S? B.O、S、P? C.O、F、Cl? D.C、Si、P
参考答案:A
本题解析:根据题意X、Y、Z在周期表中的位置有如下情况:⑴XY、⑵XY、⑶YX、⑷YX,再根据最外层电子数总和是17,核内质子数总和是31知X、Y、Z分别是N、O、S 。
本题难度:简单
3、选择题 下列分离物质的方法中,不是根据粒子大小进行分离的是
A.渗析
B.蒸馏
C.过滤
D.膜分离
参考答案:B
本题解析:
本题难度:简单
4、填空题 (9分)下表为周期表的一部分,其中的编号代表对应的元素。

(1)写出上表中的元素⑩原子的外围电子排布式?。
(2)在元素③与①形成的水果催熟剂气体化合物中,元素③的杂化方式为?杂化,元素⑦与⑧形成的化合物的晶体类型是?。
(3)元素④的第一离能?元素⑤(填“>”、“=”或“<”)的第一电离能;元素④与元素①形成的X分子的空间构型为?。
(4)在测定①与⑥形成化合物的相对分子质量时,实验测得的值一般高于理论值的主要原因是?。
(5)将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,其离子方程式为?
参考答案:(9分)(1)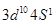 。(1分)
。(1分)
(2)SP2、离子晶体
(3)>、三角锥形
(4)HF分子间易形成氢键,气态HF中存在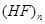
(5)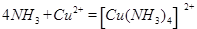
本题解析:考查元素周期表及元素周期律的知识
(1)元素⑩为铜,为ds区域元素,外围电子排布式为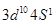
(2)元素③与①形成的水果催熟剂气体化合物为乙烯,碳原子为sp2杂化;元素⑦与⑧形成的化合物为氯化镁,由活泼金属与非金属通过电子的得失形成,为离子化合物
(3)由于N元素的核外电子的半充满结构,第一电离能N相对较大;X为氨气,分子结构为三角锥形
(4)①与⑥形成化合物为HF,由于分子之间易形成氢键,缔合为大分子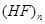 ,故实测的相对分子质量一般高于理论值
,故实测的相对分子质量一般高于理论值
(5)将过量氨气通入硫酸铜溶液中可形成铜氨络离子: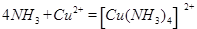
本题难度:一般
5、填空题 (8分)A、B、C、D、E五种元素在周期表里的位置如下表所示:A、B、C为同主族元素,A为该族中原子半径最小的元素;D、B、E为同周期元素,E为该周期中原子半径最小的元素。D元素名称是 ,在周期表第 周期,第 族,其原子结构示意图 ? 。
?
| A
| ?
|
D
| B
| E
|
?
| C
| ?
参考答案:_磷__ 、第 3?周期,第 VA 族,原子结构示意图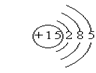
本题解析:由上述位置关系,结合E为该周期中原子半径最小的元素,则E是第三周期的氯元素,其它元素就分别为:A是氧、B是硫、C是硒,D是磷、E是氯,这样上面问题就迎刃而解。
本题难度:一般
|