1、选择题 已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,A在反应中既不容易得电子也不容易失电子,元素B的最外层电子数是电子层数的3倍,元素D与A为同族元素,元素C和E形成的化合物CE是海水中的主要成分。下列说法不正确的是
A.离子半径:r(E)>r(B)>r(C)
B.熔点:CE>DE4
C.C与B形成的两种化合物中化学键类型不同
D.A、D、E的最高价氧化物对应水化物的酸性逐渐增强
参考答案:D
本题解析: A在反应中既不容易得电子也不容易失电子,因此A是第ⅣA族元素,元素D与A为同族元素,所以根据原子序数A小于D可知,A应该是碳元素,则D是硅元素。元素B的最外层电子数是电子层数的3倍,原子序数大于碳元素而小于硅元素,则B是氧元素。元素C和E形成的化合物CE是海水中的主要成分,因此C是钠元素,E是氯元素。A、离子的核外电子层数越多,离子半径越大。核外电子排布相同的微粒离子半径随原子序数的增大而减小,因此离子半径:r(E)>r(B)>r(C),A正确;B、氯化钠形成的晶体是离子晶体,四氯化硅形成的晶体是分子晶体,因此熔点CE>DE4,B正确;C、C与B形成的两种化合物是氧化钠和过氧化钠,前者含有离子键,后者含有离子键和非极性键,中化学键类型不同,C正确;D、非金属性越强,最高价氧化物对应水化物的酸性逐渐增强,非金属是Cl>C>Si,所以D、A、E的最高价氧化物对应水化物的酸性逐渐增强,D不正确,答案选D。
本题难度:一般
2、选择题 英国《自然》杂志曾报道,科学家用DNA制造出一种臂长只有7nm的纳米(1nm=10-9m)级镊子,这种镊子能钳起分子或原子,并对它们随意组合,下列分散系中分散质的微粒直径与纳米级镊子具有相同数量级的是
A.溶液
B.乳浊液
C.悬浊液
D.胶体
参考答案:D
本题解析:分析:据分散质的微粒直径大小判断.
解答:纳米级镊子的直径在1-100nm之间,溶液中溶质的直径<1~100nm,悬浊液、乳浊液分散质粒子直径>1~100nm,胶体粒子的直径在1~100nm之间;答案为胶体;
故选D.
点评:本题考查了胶体分散系的本质特征,主要掌握分散质微粒直径的大小.
本题难度:简单
3、填空题 A、B、C、D、E五种短周期元素,原子序数按A、B、C、D、E依次增大,A元素原子失去1个电子后变为质子,B元素原子的最外层电子数比次外层电子数多2个, C元素原子的最外层电子数是次外层电子数的3倍,D元素原子最外层电子数为1,E元素原子的最高价与负价的绝对值之差为4。试回答:
(1)E元素在元素周期表中的位置是?
(2)由A、C二种元素共同组成的化合物中既含极性键又含非极性键的是?,
只含极性键的是?(填化学式)。
(3)D与E可形成化合物,用电子式表示该化合物?
(4)用电子式表示B、C两元素形成稳定化合物的过程?
参考答案:(1) 第三周期第ⅥA族? (2) H2O2? H2O
(3)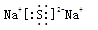 ? (4)
? (4) 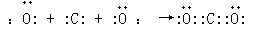
本题解析:由题意可知:A、B、C、D、E五种元素分别为:H、C、O、Na、S
(1)E元素在元素周期表中的位置是第三周期第ⅥA族;
(2)由A、C二种元素共同组成的化合物中既含极性键又含非极性键的是H2O2;只含极性键的是H2O;
(3)D与E可形成化合物,用电子式表示该化合物为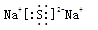
(4)用电子式表示B、C两元素形成稳定化合物的过程为:

本题难度:一般
4、选择题 X2-的核外电子排布为2、8、8,则X元素在周期表中的位置是
A.第三周期0族
B.第三周期VIA族
C.第三周期VIIA族
D.第四周期IA族
参考答案:B
本题解析:X2-的核外电子排布为2、8、8,说明X原子的核外电子数是16,为硫元素,位于元素周期表的第三周期VIA族,答案选B。
本题难度:一般
5、选择题 下列说法中错误的是
A.SO2、SO3都是极性分子
B.在NH4+和[Cu(NH3)4]2+中都存在配位键
C.元素电负性越大的原子,吸引电子的能力越强
D.PCl3和NF3分子中所有原子的最外层都达到8电子稳定结构
参考答案:A
本题解析:A、SO2是极性分子;而SO3却是非极性分子。错误。B、在NH4+中的N与H原子间存在配位键;在 [Cu(NH3)4]2+中的N与Cu原子间也存在配位键。正确。C、元素电负性是表示元素的原子吸引电子能力大小的,元素的非金属性越强,其电负性就越大,吸引电子的能力越强。正确。D、PCl3和NF3分子中N、P最外层都有5个电子,分别与Cl或F原子形成也三个共用电子对,达到8电子稳定结构;而Cl或F原子最外层有7个电子,形成一对共用电子对后也达到8电子稳定结构。正确。
本题难度:一般