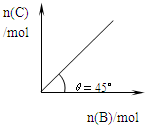1、简答题 用“>”、“<”或“=”填空:
(1)同温同压下,H2(g)+Cl2(g)=2HCl(g),光照和点燃条件的△H(化学计量数相同)分别为△H1、△H2,△H1______△H2;
(2)相同条件下,2mol氢原子所具有的能量______1mol氢分子所具有的能量;
(3)已知常温时红磷比白磷稳定,比较下列反应中△H的大小:△H1______△H2.
①4P(白磷,s)+5O2(g)=2P2O5(s)△H1,
②4P(红磷,s)+5O2(g)=2P2O5(s)△H2;
(4)已知:101kPa时,2C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1,则碳的燃烧热数值______110.5kJ?mol-1;
(5)已知:稀溶液中,H+(aq)+OH?(aq)=H2O(l)△H=-57.3kJ/mol,则浓硫酸与稀NaOH溶液反应生成1mol水,放出的热量______57.3kJ;
(6)可逆反应:aA(气)+bB(气)?cC(气)+dD(气);△H=Q,根据图回答:

①P1______?P2;?②(a+b)______(c+d);?③t1℃______?t2℃.
参考答案:(1)反应热与反应物的总能量和生成物的总能量,与反应条件无关,则光照和点燃条件的△H相同,
故答案为:=;
(2)氢气分子生成氢原子要破坏化学键,需要吸热,则2mol氢原子所具有的能量大于1mol氢分子所具有的能量,
故答案为:>;
(3)常温时红磷比白磷稳定,说明白磷能量高,反应放出的热量较多,因△H<0,则放出的能量越多反应热越小,
故答案为:<;
(4)燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,碳完全燃烧生成二氧化碳,放出的热量比生成一氧化碳多,故答案为:>;
(5)浓硫酸溶于水放热,放出的热量多余57.3kJ,故答案为:>;
(6)①压强越大,反应速率越大,达到平衡用时越少,故答案为:<;
②增大压强A%降低,说明平衡向逆方向移动,则反应物气体的计量数之和小于生成物气体的化学计量数之和,
故答案为:<;
③温度越高,反应速率越大,达到平衡用时越少,故答案为:>.
本题解析:
本题难度:一般
2、选择题 化学中常用图像直观地描述化学反应的进程或结果,下列图像描述正确的是?

A.图①可以表示对某化学平衡体系改变温度后反应速率随时间的变化
B.图②表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(g)的影响,且乙的压强大
3C(g)+D(g)的影响,且乙的压强大
C.图③表示向Al2(SO4)3和MgSO4的混合液中滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液体积的关系
D.图4表示在2L的密闭容器中发生合成氨反应时N2的物质的量随时间的变化曲线,0~10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d
参考答案:BD
本题解析:改变温度,正、逆反应速率同时增大或减小,A错误;D是固体,增大压强。平衡不移动,反应速率加快,达到平衡需要的时间缩短,B正确;向硫酸镁和硫酸铝溶液中加入氢氧化钠溶液至过量,最终仍有氢氧化镁沉淀,C错误;纵坐标表示氮气物质的量,压缩容器体积的瞬间,氮气物质的量不变,体积缩小等效于增大压强,平衡向右移动,氮气物质的量减小,D正确。
点评:理解勒沙特列原理并学会灵活运用。
本题难度:一般
3、选择题 某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g) 
参考答案:
本题解析:
本题难度:一般
4、填空题 在25℃时,2L的密闭容器中A、B、C三种气体的初始浓度和平衡浓度如下表:
物 质
| A
| B
| C
|
初始浓度/mol·L-1
| 1.0
| 2.0
| 0
|
2min时,平衡浓度/mol·L-1
| 0.4
| 0.2
| 1.2
|
请填写下列空白:
(1)该反应方程式可表示为 ;反应达平衡时,A的转化率为 。
(2)从反应开始到达化学平衡,反应物A的平均反应速率为 ;25℃时,反应的化学平衡常数K值为_____________。
(3)若已知该反应为放热反应,下图表示由于条件改变而引起反应速度和化学平衡的变化情况:a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 。

(4)如果上述反应起始是按“1molA+3molB”充入,达平衡时C的浓度为a mol/L;维持容器体积和温度不变,按下列方法改变起始物质的量,达到平衡时C的浓度仍为a mol/L的是 (填序号):
①2 mol A+6 mol B ②2mol C ③4mol C ④0.5 mol A+1.5mol B+1 mol C
参考答案:(每空2分,共14分)
(1)A(g) + 3B(g) 2C(g) (2分) 60%(2分)
2C(g) (2分) 60%(2分)
(2)0.3 mol/(L
本题解析:
本题难度:困难
5、选择题 在盛有足量A的体积可变的密闭容器中,保持压强一定,加入B,发生反应:A(s)+2B(g)?

?4C(g)+D(g);△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变化关系如图.下列说法正确的是( )
A.若当温度升高后,则图中θ>45°
B.若再加入B,则正、逆反应速率均逐渐增大
C.若再加入B,则再次达到平衡时反应体系气体密度减小
D.平衡时B的转化率为50%