1、填空题 (14分)(I)、A、B、C、D、E、F六种物质的组成元素均为短周期元素,它们的转化关系如图。其中反应①为置换反应。
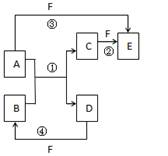
(1)若A、D、F为非金属单质,且A、D同主族,A、F同周期,则F是??,反应①的化学方程式为??;
(2)(若B、C、F都是气态单质,且B有毒,③、④反应中都有水生成,反应②需在放电条件下进行,写出反应①的化学方程式为??,反应③为?热反应
(3)若A、D为单质,且所含元素的原子序数A是D的两倍,原子的最外层电子数D是A的两倍, F是D相邻元素的最高氧化物的水化物,反应①的实验现象是:
反应④的化学方程式为??(F为浓溶液)
(II)X、Y、Z、W 4种元素。已知:①X+和Y-两种离子具有相同的电子层结构;②Z元素原子核内质子数比Y元素原子核内质子数少9个;③Y和Z两元素可以形成四核41个质子的负一价阴离子;④W元素原子最外电子层上的电子数占其电子总数的三分之二。据此填空: Y元素是?,Z元素是?。由W、Z两元素所形成的含22个电子的化合物A的结构式是?;由X、Y、Z三元素按原子个数比为1:1:1形成的化合物B的电子式是?。
参考答案:(14分)(I)O2?( 1分)? SiO2+ 2C?=SiO2?+2CO( 2分)
2NH3+ 3Cl2?= N2+6HCl?( 2分)放热( 1分)?镁条燃烧,发出白光,生成黑白两种固体( 2分)? C +4HNO3(浓)?=CO2↑+4NO2↑+2H2O ( 2分)(条件略)
(II)Cl( 1分)、O( 1分)? ,O=C=O( 1分) ,K+〔︰O︰Cl︰〕-( 2分)
本题解析:(1)同主族间的非金属单质的置换反应,符合题意的只有SiO2与C的反应。
(2)突破口在于反应②需在放电的条件下进行,则为N2与O2放电反应生成NO气体。且B为有毒气体单质,通常为CL2,即可知反应①为工业上检查氯气是否泄漏的方法。反应③这为氨的催化氧化,属于放热反应。
(3)符合A、D为单质,且所含元素的原子序数A是D的两倍,的置换反应为Mg与CO2气体的反应。
(II)X、Y、Z、W 4种元素对应的元素符号为:K、CL、O、C。
本题难度:简单
2、简答题 根据如图物质之间的转化关系,回答:
(1)写出A、B、C的化学式:A______;B______;C______.
(2)写出下列各步的化学反应方程式:
A→B:______;
A→Cu:______.
参考答案:AFe
本题解析:
本题难度:一般
3、简答题 图中A~J分别代表一种反应物或生成物,已知A受热分解得到等物质的量的B、C、D气态物质,图中部分生成物未列出
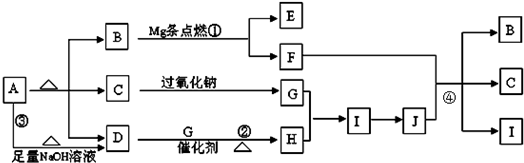
请回答:
(1)B的结构式______,D分子的空间构型为______;
(2)写出反应①、④的化学方程式
? ? ?①______;
? ? ?④______;
(3)写出反应③的离子方程式______;
(4)写出有C参加的且C只做还原剂的氧化还原反应化学方程式______;
(5)将D和G以1:2混合在催化剂的作用下充分反应后无气体剩余,则生成溶液中溶质的质量分数______?(用分数表示).
参考答案:A在加热的条件下能与NaOH反应生成D为常温下气态物质,说明A为铵盐,D为NH3,A分解得到等物质的量的B、C、D,
B为常温下为气体,又能与镁反应,考虑B为CO2,C能与过氧化钠反应,考虑C为H2O,G为O2,则A为NH4HCO3,
氨气与氧气反应生成NO,NO与氧气反应生成NO2,H为NO,I为NO2,则J为HNO3,镁与二氧化碳反应生成MgO与C,C与浓硝酸反应生成CO2、NO2、H2O,E为MgO,F为碳,符合转化关系,
(1)由上述分析可知,B为CO2,碳原子与氧原子之间形成2对共用电子对,结构式为O=C=O,D为NH3,N原子形成3个N-H单键,含有1对孤对电子,采取sp3杂化,分子的空间构型为三角锥型,故答案为:O=C=O,三角锥型;
(2)反应①是镁在二氧化碳中燃烧生成氧化镁与碳,反应方程式为:2Mg+CO2?点燃?.?2MgO+C,
反应④是碳与浓硝酸反应生成二氧化碳、二氧化氮、水,反应方程式为:C+4HNO3 (浓)?△?.?CO2↑+4NO2↑+2H2O,
故答案为:2Mg+CO2?点燃?.?2MgO+C,C+4HNO3 (浓)?△?.?CO2↑+4NO2↑+2H2O;
(3)反应③是碳酸氢铵与氢氧化钠反应生成氨气、碳酸钠、水,离子方程式为:NH4++HCO3-+2OH-═NH3↑+CO32-+2H2O,
故答案为:NH4++HCO3-+2OH-═NH3↑+CO32-+2H2O;
(4)有H2O参加且只做还原剂的氧化还原反应,为氟气与水反应生成HF与氧气,反应方程式为2F2+2H2O=4HF+O2,
故答案为:2F2+2H2O=4HF+O2;
(5)将NH3和O2以1:2混合在催化剂的作用下充分反应,没有无气体剩余,发生的总反应式为:NH3+2O2=HNO3+H2O,生成的HNO3与H2O的物质的量之比为1:1,故生成硝酸溶液中溶质的质量为6363+18×100%=79,故答案为:79.
本题解析:
本题难度:一般
4、填空题 (12分)短周期中的A、B、C、D、E 5种元素,原子序数依次增大,A、D同主族;A、B 的原子序数之和等于C的原子序数;C2?离子与D+离子的核外电子数相等;B原子与D+离子的核外电子数之和等于E原子的核外电子数,
的原子序数之和等于C的原子序数;C2?离子与D+离子的核外电子数相等;B原子与D+离子的核外电子数之和等于E原子的核外电子数, 且D、E两元素能形成微粒个数比为1︰1的离子化合物。
且D、E两元素能形成微粒个数比为1︰1的离子化合物。
(1)E元素的离子结构示意图为________。
(2)A与B元素、A与C元素均可构成18电子的分子,其化学式分别为______、_______。
(3)A、C元素可组成原子个数比为1︰1的共价化合物乙,将E单质通入乙的水溶液中,生成一种强酸,并有气体放出,反应的化学方程式为?。
(4)A、B、C、D、E中的任意三种元素可组成多种化合物,X和Y是其中的两种。X和Y都是既含离子键又含共价键的离子化合物;将X、Y分别溶于水时,X能促进水的电离,而Y能抑制水的电离,X水溶液的pH<7,Y水溶液的pH>7。
将0.2mol·L?1的X溶液与0.1mol·L?1的Y溶液等体积混合后,溶液呈碱性。请判断:
①X的化学式为?,Y的化学式为?;
②混合溶液中各种带电微粒的物质的量浓度由大到小的顺序为?
?。
参考答案:(12分)(1)?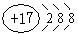 ?(2分)
?(2分)
(2)N2H4? (1分)? H2O2? (1分)
(3)Cl2+H2O2=2HCl+O2↑(答HClO+H2O2=HCl+O2↑+H2O可得分) (2分)
(4)①NH4Cl(或NH4NO3) (2分),NaOH (2分);
②c(Cl?)>c(NH4+)>c(Na+)>c(OH?)>c(H+)
[或c(NO3?)>c(NH4+)>c(Na+)>c(OH?)>c(H +)](2分)
+)](2分)
本题解析:略
本题难度:简单
5、填空题 (5分)在下列中学化学中常见物质的转化关系图中,已知常温下A为淡黄色固体、B为金属单质,D、E、M是常见气体单质,其中M为黄绿色,N是胃酸主要成分,工业上用E和M来制取N,试推断:
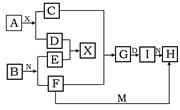
(1)写出下列化学式? A??I?
(2)G转化为I的现象为?
(3)F+M→H离子方程式为?
(4)A+X→C+D的化学方程式为________________________
参考答案:(1)Na2O2、Fe(OH)3。(2)白色沉淀迅速转化为灰绿色,最后转化为红褐色。
(3)2Fe2++Cl2=2Fe3+?(4)2Na2O2+2H2O=4NaOH+O2↑
本题解析:M为黄绿色,则M是氯气,N是胃酸主要成分,则N是氯化氢。A为淡黄色固体,因此A是过氧化钠。B为金属单质,则E是氢气,F和氯气可以继续反应,说明B是变价金属,即为铁,所以F是氯化亚铁。H是氯化铁。D和氢气反应,所以D是氧气。X是水,C是氢氧化钠,G是氢氧化亚铁,I是氢氧化铁。
本题难度:一般