1、选择题 某白色固体可能由①NaOH、②Al2(SO4)3、③NaAlO2、④AgNO3、⑤NH4NO3中的一种或几种组成,此固体投入水中得澄清溶液,该溶液可使酚酞呈红色,若向该溶液中加稀硝酸到过量,有白色沉淀产生.则对原固体的判断正确的是( )
A.肯定含有③
B.肯定存在①、④、⑤
C.可能存在①和②
D.可能存在②和③
参考答案:B
本题解析:
本题难度:简单
2、填空题 (7分)下图各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1∶1。甲是发酵粉的主要成分,乙是一种常用的化肥。B、D常温常压下是气体。请回答下列问题:
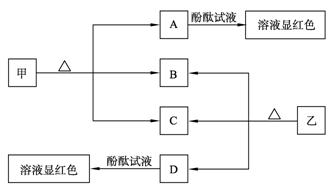
(1)甲的俗名是____________________ ________。
________。
(2) A、D物质的水溶液分别滴入酚酞试液后,溶液均显红 色,说明溶液均显性,其原理是否相同?请用必要的文字加以解释并写出离子方程式:
色,说明溶液均显性,其原理是否相同?请用必要的文字加以解释并写出离子方程式:
__________________________________________________________。
(3)向饱和氯化钠溶液中通入气体D至饱和后,再通入足量的气体B可制得物质甲,写出该反应的化学方程式:__________________________________________。
参考答案:(7分)(1)小苏打(1分)
(2)碱(1分);不相同。碳酸钠水解显碱性CO32- +H2O  ?HCO3- +OH-
?HCO3- +OH-
氨气溶于水生成的NH3·H2O电离显碱性NH3·H2O  ?NH 4
?NH 4 + + OH-所以加入酚酞后溶液显红色(3分。其它合理答案同样给分)
+ + OH-所以加入酚酞后溶液显红色(3分。其它合理答案同样给分)
(3) NaCl + CO2+H2O+NH3=NaHCO3↓+NH4Cl(2分)
本题解析:略
本题难度:一般
3、简答题 A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B.用圆底烧瓶收集干燥的B,按图1装置仪器,挤压滴管的胶头时,可以得到蓝色喷泉;实验室也可用A与浓H2SO4反应制无色气体C,C气体能使品红溶液褪色.用圆底烧瓶收集干燥的C,仍按图1装置仪器,挤压滴管的胶头时,可以得到红色喷泉.
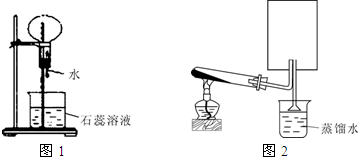
(1)A晶体的化学式是______,B气体的化学式______
(2)图2是制取并收集气体B的部分装置,在图中方框内绘出用圆底烧瓶收集B的仪器装置简图,图中倒置漏斗的作用______
(3)若用一支试管来收集B,检验B气体是否收集满的方法及现象是______.
参考答案:(1)A与NaOH反应生成气体,该气体能使石蕊试液变蓝,说明该气体为NH3,则A应为铵盐,C气体能使品红褪色,应为SO2,则A应为亚硫酸氢盐或亚硫酸盐,所以A为(NH4)2SO3或NH4HSO3,
故答案为:(NH4)2SO3或NH4HSO3;NH3;
(2)氨气极易溶于水,且密度比空气小,应用向下排空气法收集,可用

装置收集,为防止倒吸,应用倒置漏斗贴近液面进行尾气吸收,故答案为:

;防倒吸;
(3)氨气水溶液呈碱性,能使湿润的红色石蕊试纸变蓝,则验满方法可为将湿润的红色石蕊试纸放在试管口,若试纸变蓝,则说明已收集满,
故答案为:将湿润的红色石蕊试纸放在试管口,若试纸变蓝,则说明已收集满.
本题解析:
本题难度:一般
4、推断题 A、B、C是在中学化学中常见的三种化合物,它们各由两种元素组成,甲、乙是两种单质.这些化合物和单质之间存在如下的关系:
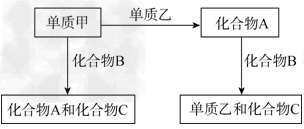
据此判断:
(1)在A、B、C这三种化合物中,必定含有乙元素的是______。(用A、B、C字母填写)
(2)单质乙必定是________(填“金属”或“非金属”),其理由是________。
(3)单质乙的分子式可能是________,则化合物B的分子式是________。
参考答案:(1)A、B
(2)非金属? ;A+B→乙+C,由氧化还原反应规律(归中律)可知乙元素在A、B两种化合物中一定有一种是负化合价,所以乙是非金属
(3)S ;H2S(或N2 ;NH3)
本题解析:
本题难度:一般
5、简答题 已知A、B、D、E四种物质中均含有同一种短周期元素,该元素原子的最外层电子数是内层电子数的3倍,D为气体单质,E为黑色粉末.如图转化关系中E均起催化作用(某些产物已略去).
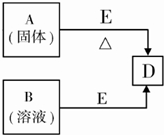
则:
(1)A的化学式为______;B分子的电子式为______;
(2)已知E与含A中某元素的浓酸在一定条件下反应,产生一种含有该元素的气体X.甲同学为探究该气体的性质,设计了如图装置(III中夹持装置已略去).
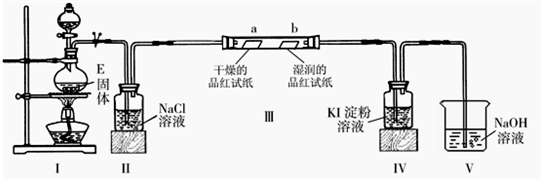
①I中发生反应的离子方程式为______;
②实验开始不久,观察到装置IV中的现象为______;
③实验结束后,该同学在装置III中观察到b的红色褪去,而没有出现“a无明显现象”这一预期现象.为达到实验目的,他在装置______(填装置序号)之间又添加了洗气瓶,该装置的作用是______;
(3)将气体X通入到紫色的石蕊试液中,观察到的现象是______;
(4)气体X能与溶液B反应,生成气体D,试写出该反应的化学方程式:______.
参考答案:已知A、B、D、E四种物质中均含有同一种短周期元素,该元素原子的最外层电子数是内层电子数的3倍,应为O元素,D为气体单质,应为O2,E为黑色粉末,应为MnO2,根据物质的状态和反应条件下可知A为KClO3,B为H2O2,都可在MnO2作用下生成氧气,E与含A中某元素的浓酸在一定条件下反应,产生一种含有该元素的气体X,应为MnO2与浓盐酸的反应,生成X为Cl2,
(1)由以上分析可知A为KClO3,B为H2O2,电子式为
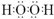
,故答案为:KClO3;
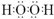
;
(2)①Ⅰ为制取氯气的发生装置,反应的方程式为MnO2+4H++2Cl-??△?.? Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-??△?.? Mn2++Cl2↑+2H2O;
②氯气具有氧化性,与KI反应生成碘单质,淀粉遇碘变蓝色,故答案为:溶液变蓝;
③为验证干燥的氯气不具有漂白性,则通入Ⅲ中的氯气应为干燥后的氯气,应装置II和III添加盛有浓硫酸的洗气装置,用以除去氯气中的水蒸气,
故答案为:装置II和III;除去氯气中的水蒸气(或:干燥氯气);
(3)氯气与水反应生成盐酸和次氯酸,次氯酸具有漂白性,可使紫色的石蕊试液先变红后褪色,故答案为:紫色的石蕊试液先变红后褪色;
(4)气体Cl2能与溶液H2O2反应,生成气体O2,该反应的方程式为Cl2+H2O2=2HCl+O2,故答案为:Cl2+H2O2=2HCl+O2.
本题解析:
本题难度:一般