1、选择题 某温下,在BaSO4饱和溶液中加入少量BaCl2溶液,产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积,则平衡后溶液中( )
A.[Ba2+]=[SO42-]=Ksp?
B.[Ba2+]?[SO42-]>Ksp[Ba2+]=[SO42-]
C.[Ba2+]?[SO42-]=Ksp[Ba2+]>[SO42-]
D.[Ba2+]?[SO42-]≠Ksp[Ba2+]<[SO42-]
参考答案:A、加入氯化钡溶液会生成硫酸钡沉淀,溶液中钡离子浓度和硫酸根离子浓度不再相等,故A错误;
B、加入氯化钡溶液会生成硫酸钡沉淀,溶液中钡离子浓度和硫酸根离子浓度不再相等,最后溶液中的溶度积常数不变,故B错误;
C、加入氯化钡溶液会生成硫酸钡沉淀,溶液中钡离子浓度和硫酸根离子浓度不再相等,钡离子浓度大于硫酸根离子浓度,最后溶液中的溶度积常数不变,故C正确;
D、溶度积常数是随温度变化不随浓度改变,最后溶液中的溶度积常数不变,钡离子浓度大于硫酸根离子浓度,故D错误;
故选C.
本题解析:
本题难度:一般
2、选择题 常温下,AgCl、AgBr、AgI的溶度积(Ksp)依次为1.8×10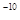 、5.0×10
、5.0×10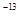 、8.3×10
、8.3×10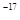 。下列有关说法错误的是? (? )
。下列有关说法错误的是? (? )
A.常温下在水中溶解能力AgCl>AgBr>Agl
B.在AgCl饱和液中加入足量浓NaBr溶液有AgBr沉淀生成
C.在AgBr饱和溶液中加入足量浓NaCl溶液不可能有AgCI沉淀生成
D.在AgI饱和液中加入NaI固体有AgI沉淀析出
参考答案:C
本题解析:
答案:C
AgBr+Cl―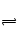 AgCl+Br―沉淀转换平衡,也是可逆反应,改变条件可使平衡向某个方向移动。C,只要提高Cl―的浓度,平衡就可以向生成AgCl的方向移动。
AgCl+Br―沉淀转换平衡,也是可逆反应,改变条件可使平衡向某个方向移动。C,只要提高Cl―的浓度,平衡就可以向生成AgCl的方向移动。
本题难度:简单
3、填空题 “烂板液”是制印刷锌板时,用稀HNO3腐蚀锌板后得到的废液,主要含Zn(NO3)2和由自来水带进的Cl-、Fe3+等杂质离子.在实验室中由“烂板液”制取ZnSO4?7H2O的过程如下:
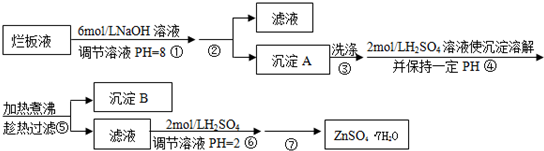
已知有关金属离子形成氢氧化物沉淀时的PH见下表:
| 离子 | 开始沉淀时的PH | 完全沉淀时的PH
Fe3+
1.9
3.2
Zn2+
6.4
8.0
|
(1)第①反应是使Zn2+、Fe3+沉淀,检验Fe3+是否沉淀完全的操作是______.
(2)第②步操作中需要的玻璃仪器有______.
(3)第④步中PH应保持在______.
(4)第⑥步调节溶液PH=2的目的是______.
(5)操作⑦包含3个基本实验操作,它们是______、______和过滤.
参考答案:(1)用SCN-检验Fe3+是否有剩余,故答案为:取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe(OH)3 沉淀完全;
(2)过滤需要用到玻璃仪器有漏斗、玻璃棒、烧杯,故答案为:漏斗、玻璃棒、烧杯;
(3)第④步目的是使Fe3+完全沉淀,Zn2+不沉淀故应调节PH为3.2~6.4,故答案为:3.2~6.4;
(4)锌离子易水解生成氢氧化锌,酸性条件下可抑制锌离子的水解,故答案为:抑制Zn2+水解;
(5)操作⑦包括蒸发浓缩,冷却结晶,过滤,故答案为:蒸发浓缩;冷却结晶(或降温结晶).
本题解析:
本题难度:一般
4、选择题 AgCl和Ag2CrO4的溶度积分别为1.8×10-10 mol2·L-2和2.0×10-12 mol3·L-3,若用难溶盐在溶液中的浓度来表示其溶解度,则下面的叙述中正确的是
A.AgCl和Ag2CrO4的溶解度相等
B.AgCl的溶解度大于Ag2CrO4的溶解度
C.两者类型不同,不能由Ksp的大小直接判断溶解能力的大小
D.都是难溶盐,溶解度无意义
参考答案:C
本题解析:当用浓度来表示其溶解度时,由二者的浓度积可求出AgCl和Ag2CrO4的溶解度分别为1.8×10—5 mol/L、1..26×10—4 mol/L,所以AB说法错误;D说法显然不正确,答案为C
本题难度:一般
5、选择题 当光束通过下列分散系时,能产生丁达尔效应的是
A.蔗糖水
B.食盐水
C.豆浆
D.小苏打水
参考答案:C
本题解析:豆浆是胶体,能产生丁达尔效应,其它选项都是溶液。
本题难度:一般