1、选择题 下列物质中、属于纯净物的是
A.新鲜空气
B.加碘食盐
C.冰和水的混合物
D.海水
参考答案:C
本题解析:分析:依据纯净物概念分析判断,纯净物是同物质组成的;
解答:A、空气是混合物,故A错误;
B、加碘食盐是碘酸钾和氯化钠的混合物,故B错误;
C、冰和水的混合物是水属于纯净物,故C正确;
D、海水是氯化钠、氯化镁等电解质属于混合物,故D错误;
故选C.
点评:本题考查了纯净物的概念应用,主要是根据物质的组成分析判断,较简单 91EXAm.org.
本题难度:简单
2、选择题 下列能层中,有f能级的是
A.K
B.L
C.M
D.N
参考答案:D
本题解析:略
本题难度:简单
3、选择题 根据元素周期表和元素周期律,下列推断中错误的是?
A.砹是一种有色固体,它的气态氢化物很不稳定砹化银为有色沉淀且不溶解于稀硝酸,很容易分解
B.在周期表中金属和非金属元素的分界线附近可以寻找半导体材料
C.铷的硫酸盐易溶解于水,其氢氧化物一定是强碱
D.溴化氢没有氯化氢稳定,其水溶液的酸性是盐酸>氢溴酸
参考答案:D
本题解析:同主族元素自上而下非金属性逐渐减弱,金属性逐渐增强,A、C正确。选项B属于周期表的具体应用,正确。非金属性越强,最高价氧化物对应的水化物的酸性越强,而不是氢化物的酸性,D不正确。答案是D。
本题难度:简单
4、选择题 铀 是重要的核工业原料,在自然界中的含量很低。下列有关铀
是重要的核工业原料,在自然界中的含量很低。下列有关铀 的说法正确的是
的说法正确的是
A.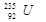 与
与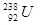 的性质完全相同
的性质完全相同
B.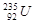 原子核中含有143个中子
原子核中含有143个中子
C. 属于短周期元素
属于短周期元素
D.1mol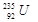 的质量是143g
的质量是143g
参考答案:B
本题解析: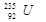 与
与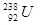 的质子数相同,中子数不同,二者互为同位素,化学性质相似,物理性质不同,A不正确;中子数+质子数=质量数,则
的质子数相同,中子数不同,二者互为同位素,化学性质相似,物理性质不同,A不正确;中子数+质子数=质量数,则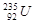 原子核中含有235-92=143个中子,B正确;
原子核中含有235-92=143个中子,B正确; 是锕系元素,位于第七周期,属于长周期元素,C不正确;
是锕系元素,位于第七周期,属于长周期元素,C不正确;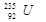 的的相对原子质量近似是235,所以1mol
的的相对原子质量近似是235,所以1mol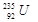 的质量是235g,D不正确,答案选B。
的质量是235g,D不正确,答案选B。
点评:该题是常识性知识等考查,难度不大。主要是考查学生对原子组成以及组成原子的几种微粒之间数量关系的了解掌握情况,意在培养学生分析、概念和总结问题的能力。
本题难度:简单
5、填空题 (12分)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排布式为ns2np2,且原子半径是同族元素中最小的。
②Y元素是地壳中含量最多的元素;W在同周期中原子半径最小,在W原子的电子排布中,
p轨道上只有1个未成对电子。
③Z元素的电离能数据见下表(kJ/mol):
I1
| I2
| I3
| I4
| ……
|
496
| 4562
| 6912
| 9540
| ……
|
请回答:
(1)Z2Y2的电子式为___________, Z2Y2与水反应的化学方程式??
(2)X、Y二种元素所形成的常见稳定的化合物的晶体类型为________ ,空间构型为________
(3)X、Y、Z、W四种元素所形成的单质中,硬度最大、熔点最高的是_____________ (填名称); XW4的结构式为_______________
参考答案:(每空2分共12分)
(1) 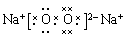 ?
?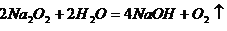
(2) 分子晶体 直线形? (3)金刚石 ?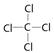
本题解析:根据①可知X是第ⅣA元素,因此是碳元素。地壳中含量最高的是氧元素,则Y是氧元素。根据Z的电离能可知,Z是第IA元素。又因为Z的原子序数大于氧元素的,所以Z是短周期中的钠元素。同周期元素中原子半径最小的是第ⅦA元素。又因为W原子序数大于钠的,所以W是氯元素。
(1)过氧化钠是含有离子键和非极性键的离子化合物,和水反应生成氢氧化钠和氧气。
(2)碳元素的稳定氧化物是CO2,由于碳原子没有孤对电子,所以是直线型结构,属于分子晶体。
(3)金刚石是原子晶体,熔沸点最高。结构式是指用1根短线表示一对电子对的式子,所以四氯化碳的结构式为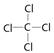
本题难度:一般