1、选择题 除去下列物质中所含少量杂质的方法不正确的是
[? ]
物质?
杂质
试剂
提纯方法
A.
CO2?
HCl
饱和Na2CO3溶液
洗气
B.
BaSO4?
BaCO3
稀盐酸
溶解、过滤、洗涤
C.
乙酸乙酯?
乙酸
饱和Na2CO3溶液
混合振荡、静置分液
D.
蛋白质?
NaCl
H2O
渗析
参考答案:A
本题解析:
本题难度:一般
2、填空题 工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产ZnSO4·6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的pH如下表。
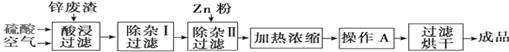 ?
?
氢氧化物
| Al(OH)3
| Fe(OH)3
| Fe(OH)2
| Zn(OH)2
|
开始沉淀的pH
| 3.3
| 1.5
| 6.5
| 5.4
|
沉淀完全的pH
| 5.2
| 3.7
| 9.7
| 8.0
|
?
(1)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有?。
(2)在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液的目的是?。
为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为?。
为控制上述PH范围可选择加入的试剂或药品是?。
A.ZnO? B.氨水? C.固体NaOH? D.ZnCO3
(3)在“除杂Ⅱ”步骤中,加入Zn粉的作用是?。“操作A”的名称是?。
(4)常温下,已知Ksp〔Cu(OH)2〕=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于?。
参考答案:(1)烧杯、玻璃棒、漏斗(3分);
(2)将Fe2+完全氧化为Fe3+,便于完全沉淀(2分);5.2~5.4(2分);AD(2分)
(3)除去溶液中的Cu2+(1分);冷却结晶(1分)
(4)5(2分)
本题解析:(1)过滤操作中需要的玻璃仪器有烧杯、玻璃棒、漏斗;
(2)溶液中的铁、铝元素最终以沉淀形式除去,所以加入适量H2O2溶液的目的是将Fe2+完全氧化为Fe3+,便于完全沉淀;根据表中数据pH=5.2时Al(OH)3完全沉淀,Fe(OH)3也已沉淀完全,但Zn(OH)2不能沉淀,所以溶液的pH范围为5.2~5.4;加入的试剂或药品既能中和酸调节pH值,同时不能引入新的杂质,所以只能选择AD;
(3)溶液中的铁、铝元素除去后仍存在铜离子,所以加入Zn粉目的是除去铜离子;加热浓缩后的步骤是冷却结晶;
(4)Ksp〔Cu(OH)2〕=2×10-20,溶液中c(Cu2+)=0.02 mol·L-1,所以只需c(Cu2+)×c(OH-)2>=2×10-20, Cu(OH)2沉淀即可生成,解得c(OH-)>=1×10-9,所以pH>=5.
本题难度:困难
3、选择题 下列括号中的分离方法运用得当的是
[? ]
A.植物油和自来水(蒸馏)
B.水溶液中的食盐和碘(分液)
C.SiO2和CaCl2(溶解、过滤、蒸发)
D.自来水中的杂质(萃取)
参考答案:C
本题解析:
本题难度:简单
4、简答题 硫酸镁是造纸、印染等行业的辅助原料.工业硫酸镁中含有MgCl2、KCl等杂质,提纯工艺路线如图一:
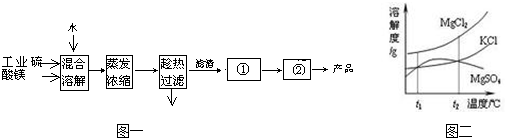
已知的溶解度(S)随温度变化的曲线如图二所示,回答下列问题:
(1)为了加速固体溶解,可采取的措施是______.
(2)为了防止液滴飞溅,进行的操作是______.
(3)实验室进行①操作所需的玻璃仪器是______,检验该操作完成的标志是______.
(4)“趁热过滤”的原因是______.
(5)若在实验室进行“趁热过滤”,可采取的措施是______.
(6)若“母液”循环使用,可能出现的问题是______.
参考答案:(1)搅拌、加热能加快固体物质的溶解.
故答案为:搅拌、加热.
(2)溶液局部受热,会造成液体飞溅,为防止液体飞溅,应使溶液受热均匀,用玻璃棒不断搅拌滤液可使滤液受热均匀.
故答案为:用玻璃棒不断搅拌滤液.
(3)过滤要用到漏斗,洗涤沉淀要用烧杯和胶头滴管;洗涤的目的是洗去可溶性的氯化钾和氯化镁,如果洗涤液中含有氯化钾和氯化镁,向滤液中滴加硝酸银溶液会产生白色沉淀,如果不产生白色沉淀说明该操作完成.
故答案为:漏斗、烧杯、胶头滴管; 取最后几滴洗涤液滴加硝酸银溶液没有沉淀产生.
(4)根据图象知,硫酸镁的溶解度随温度的降低而升高,氯化镁和氯化钾的溶解度随温度的降低而减小,所以降低温度时,氯化钾和氯化镁会析出而使硫酸镁不纯,硫酸镁的溶解度增大而使其损耗.
故答案为:防止冷却使MgSO4溶解而损耗,MgCl2和KCl因溶解度降低而析出使产品不纯.
(5)趁热过滤的方法有:滤液热、仪器热,所以可先预热过滤装置.
故答案为:先预热过滤装置.
(6)若“母液”循环使用,则MgCl2和KCl的含量增大,产品中含有的氯化镁和氯化钾几率会增大.
故答案为:若“母液”循环使用,则MgCl2和KCl的含量增大,使产品将含有MgCl2和KCl.
本题解析:
本题难度:一般
5、简答题 (1)选择提纯或分离的方法,将序号填在各项横线上.
A、萃取分液B、加热分解 C、蒸发结晶 D、分液E、蒸馏F、过滤等
①分离食盐水与泥沙的混合物______.
②分离CCl4(沸点为76.75℃)和甲苯(110.6℃)的混合物______.
③从碘水里提取碘______.
(2)实验室配制2.00mol?L-1的NaOH溶液100mL,回答下列问题.
①需要称取NaOH固体______g.配制溶液时需用______mL容量瓶.
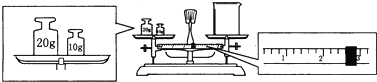
②某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.由图中可以看出,该同学在操作时有一个错误是______.烧杯的实际质量为______g.
③配制时,造成所配溶液浓度偏高的原因是______.
A.所用NaOH已吸潮
B.向容量瓶加水时液面低于刻度线即摇匀
C.有少量NaOH溶液残留在烧杯内
D.向容量瓶加水时眼睛一直仰视液面
E.容量瓶中有水未干燥就配制溶液.
参考答案:(1)①泥沙不溶于食盐水,可用过滤的方法分离,故答案为:F;
②CCl4(沸点为76.75℃)和甲苯(110.6℃)二者沸点不同可以用蒸馏的方法分离,故答案为:E;
③碘在有机溶剂中的溶解度比在水中的溶解度大得多,可用萃取分液的分离方法,故答案为:A;
(2)①根据公式计算:n=c×v=2.00mol?L-1×0.1L=0.2mol,m=M×n=0.2mol×40g/mol=8.0g,配置100ml溶液,需要用100ml的容量瓶,故答案为:8.0;100;
②天平使用时砝码放在右盘,游码的质量+右盘的质量=左盘的质量,因为顺序放反,所以游码的质量+物体的质量=砝码的质量,所以物体的质量=砝码的质量-游码的质量,30g-2.6g=27.4g,故答案为:物体和砝码放反了;27.4g;
③A.氢氧化钠吸潮,称得的氢氧化钠物质的量偏小,故A错误;
B.向容量瓶加水时液面低于刻度线即摇匀,溶液的体积V偏小,c偏大,故B正确;
C.少量氢氧化钠残留在烧杯内,使得n偏小,c偏小,故C错误;
D.向容量瓶加水时眼睛一直仰视液面,溶液的体积V偏大,c偏小,故D错误;
E.容量瓶中有水未干燥就配制溶液,对结果没有影响,故E错误;
故答案为:B.
本题解析:
本题难度:一般