| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《物质的量》高频试题强化练习(2017年最新版)(八)
参考答案:D 本题解析:电解质的电离方程式是:K2SO4=2K++SO42-;所以盐的浓度与电离产生的离子的浓度关系符合电离方程式的关系。A.n(K2SO4)=0.1mol,所以K+的物质的量为0.2 mol,错误;B.n(K2SO4)=0.1mol,所以SO42-的物质的量为0.1mol,错误;C.c(K2SO4)=" 0.1" mol/L,所以 K+的物质的量浓度为0. 2 mol/L,错误;D. c(K2SO4)=" 0.1" mol/L,所以SO42-的物质的量浓度为0. 1 mol/L,正确。 本题难度:一般 3、选择题 0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比 |
参考答案:C
本题解析:根据化学式可知,两种溶液中氯离子的物质的量分别是0.5L ×1mol/L×3=1.5mol、0.2L×1mol/L×1=0.2mol,所以溶液中二者的Cl-的数目之比15
本题难度:一般
4、选择题 相对原子质量原来以16O原子质量的十六分之一为标准,现在以12C原子质量的十二分之一为标准,二者相差0.0043%。这两种标准中数值相同的是
A.14N的质量数
B.氕原子的相对质量
C.氯元素的相对原子质量
D.氟化钠的摩尔质量
参考答案:A
本题解析:A、因质量数将原子内所有质子和中子的相对原子质量取近似整数值相加而得到的数值,无论以何种标准,质子和中子的相对原子质量取近似整数值都为1,所以14N的质量数都为14,故A正确; B、氕原子的相对原子质量以一个16O原子质量的十六分之一为标准或一个12C原子质量的十二分之一为标准,其他原子的质量跟它相比较所得到的比,氕原子的相对质量与相对原子质量的标准有关,标准不同,氕原子的相对质量也不同,故B,C错误; D、摩尔质量以g﹒mol-1为单位时,在数值上等于该物质的相对分子质量,而相对分子质量以一个16O原子质量的十六分之一为标准或一个12C原子质量的十二分之一为标准,其他分子的质量跟它相比较所得到的比,与相对原子质量的标准有关,标准不同,相对分子质量也不同,故D错误;故选:A.
本题难度:一般
5、填空题 已知实验室制氯气的化学方程式为:MnO2?+ 4HCl (浓) = MnCl2?+ Cl2+2H2O,现用足量浓盐酸在加热条件下跟1.74g二氧化锰反应制取氯气。求:
(1)产生的氯气在标准状况下的体积。
(2)把(1)中反应后的溶液稀释到100 mL,从中取出20.0 mL,加入40.0 mL 0.600 mol / L的硝酸银溶液,恰好将氯离子完全沉淀。求(1)中反应后溶液稀释到100 mL时氯离子的物质的量浓度是多少?
参考答案:(1)0.448 L?(2)1.20 mol/L
本题解析:(1)二氧化锰的物质的量是1.74g÷87g/mol=0.02mol
反应的方程式是
MnO2?+ 4HCl (浓)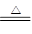 MnCl2?+ Cl2+2H2O
MnCl2?+ Cl2+2H2O
1mol? 1mol? 22.4L
0.02mol? 0.02mol? 0.448L
即生成的氯气是0.448L
(2)硝酸银的物质的量是0.04L× 0.600 mol / L=0.24mol
反应的离子方程式是
Ag+?+? Cl-=AgCl↓
1mol? 1mol
0.24mol? 0.24mol
则反应后溶液稀释到100 mL时氯离子的物质的量浓度是0.24mol÷0.02L=1.20mol/L
点评:该题是高考中的常见题型,属于基础性试题的考查。试题贴近高考,基础性强,在注重对学生基础知识巩固与训练的同时,侧重对学生能力的培养与解题方法的指导和训练。有利于提高学生的应试能力和规范答题能力。该题的关键是明确反应的原理以及物质的量浓度的计算依据,然后结合题意灵活运用即可。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《化学反应与.. | |