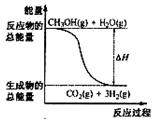
1、选择题 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);?ΔH=" +" 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);ΔH=-192.9 kJ·mol-1
下列说法正确的是
A.CH3OH的燃烧热为—192.9 kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的ΔH>-192.9kJ·mol-1
参考答案:D
本题解析:试题分析:A错,因为氢气并不是稳定的生成物,即生成的应该是水,B错误,因为①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的ΔH大于0,所以反应物的总能量应该小于生成物的总能量,C错误,因为②中的热化学方程式表明,CH3OH转变成H2的过程一定要放出能量,D正确,因为CH3OH(l)变成CH3OH(g)需要吸收能量。
考点:热化学方程式
点评:本题考查了热化学方程式,有一定的难度。解题的关键在于掌握基本概念以及坐标图中各部分的含义。
本题难度:一般
2、选择题 已知:H+(aq)+OH-(aq)===H2O(l)?△H=-57.3 kJ·mol-1。现将一定量的稀盐酸、浓硫酸、稀醋酸分别和1L 1mol·L-1的NaOH溶液恰好完全反应,其反应热分别为△H1、△H2、△H3,则△H1、△H2和△H3的大小关系为
A.△H1=△H2>△H3
B.△H3>△H2>△H1
C.△H3>△H1>△H2
D.△H2>△H1>△H3
参考答案:C
本题解析:试题分析:在稀溶液中,酸跟碱发生中和反应生成1 mol液态水时所释放的热量叫做中和热,故稀盐酸与NaOH溶液反应的反应热即为中和热;浓硫酸因溶于水大量放热,故其放出热量大于中和热;稀醋酸因溶于水发生电离,吸热,再与NaOH溶液发生放热反应,故其放出的热量小于中和热。因三者都是放热反应,故△H均为负值,放出的热量越大,则△H越小。
考点:反应热
点评:反应热是近几年高考的重点内容之一,题型一般为选择和填空,考查的内容主要有:热化学方程式的正误判断、比较反应热的大小、有关反应热的计算等。
本题难度:一般
3、选择题 下列叙述正确的是
①化学反应都遵循质量守恒定律
②化学反应都遵循能量守恒定律
③化学反应都有新物质生成
④化学反应都伴随着能量变化
⑤化学反应都有化学键的破坏和生成
A.①
B.①②⑤
C.①②③⑤
D.①②③④⑤
参考答案:D
本题解析:化学反应的特征③④⑤,同时化学反应遵守①质量守恒定律,②能量守恒定律.
本题难度:简单
4、选择题 下列属于吸热反应的是
A.金属钠与水的反应
B.氢气燃烧
C.浓硫酸的稀释
D.Ba(OH)2·8H2O和NH4Cl(固体)混合
参考答案:D
本题解析:考查常见的放热反应和吸热反应。一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。所以答案选D。
本题难度:一般
5、选择题 氢氧化钠和盐酸的反应属于
A.放热反应
B.吸热反应
C.既是吸热反应,又是放热反应
D.都不是
参考答案:A
本题解析:试题分析:中和反应是放热反应。
考点:放热反应和吸热反应
点评:判断一个反应为吸热反应或放热反应,是历年高考的常考题型,考生可根据反应基本类型进行判断,并注意积累特殊的化学反应的反应热。
本题难度:一般