1、选择题 向体积为Va的0.05 mol·L-1 CH3COOH溶液中加入体积为Vb的0.05 mol·L-1 KOH溶液,当Va>Vb时,下列关系中一定错误的是
[? ]
A.c(CH3COO-)=c(K+)
B.c(K+)<c(CH3COO-)
C.c(CH3COOH)+c(CH3COO-)>c(K+)
D.c(CH3COOH)+c(CH3COO-)<c(K+)
2、选择题 25℃时,下列溶液中微粒的物质的量浓度关系正确的是
[? ]
A.PH=7的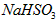 与
与 混合溶液中:
混合溶液中: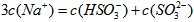
B.0.1mol·L-1的KHA溶液,其PH=10:C(K+)>C(OH-)>C(HA-) >C(H+)
C.20mL 0.1mol·L-1醋酸钠溶液与10mL 0.1mol·L-1盐酸混合后的溶液中:
 ?
?
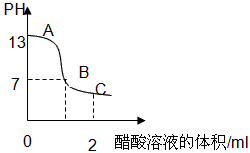
D.在25mL 0.1mol·L-1溶液中逐滴加入0.2mol·L-1溶液,溶液pH变化如下图所示,在A、B间任一点,溶液中一定都存在下列关系: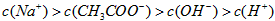
3、填空题 常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表
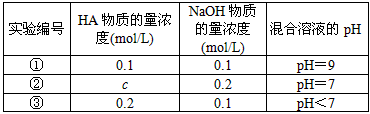
请回答
(1)从①组情况分析,HA是强酸还是弱酸?____________(填“强酸”或“弱酸”)。
(2)②组情况表明,c____________0.2 mol/L(选填“大于”、“小于”或“等于”)。混合液中离子浓度c(A-)与c(Na+)的大小关系是____________。
(3)从③组实验结果分析,说明HA的电离程度____________NaA的水解程度(选填“大于”、“小于”或“等于”),该混合溶液中离子浓度由大到小的顺序是____________。
(4)①组实验所得混合溶液中由水电离出的c(OH-)=____________mol·L-1。
4、简答题 (1)有下列物质①Cu②液态SO2③CH3COOH④NaHCO3⑤H2O⑥熔融NaCl⑦BaSO4属于弱电解质的是______(填序号)
(2)常温下,0.1mol?L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3-、CO32-、OH-四种微粒的浓度由大到小的顺序为:______.NaHCO3水解的离子方程式.
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如表:
| 实验编号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液
的pH
a
0.1
0.1
pH=9
b
c
0.2
pH=7
|
请回答:
①从a组情况分析,HA是强酸还是弱酸______.
②b组情况表明,c______0.2(选填“大于”、“小于”或“等于”)混合溶液中离子浓度
c(A-)______c(Na+).(选填“大于”、“小于”或“等于”)
③a组实验所得混合溶液中由水电离出的c(OH-)=______mol?L-1.
5、选择题 醋酸钡晶体[(CH3COO)2Ba·H2O]是一种媒染剂,易溶于水。下列有关0.1 mol/L醋酸钡溶液中粒子浓度关系的表示中,错误的是
[? ]
A.c(Ba2+)>c(CH3COO-)>c(OH-)>c(H+)
B.c(H+)+2c(Ba2+)=c(CH3COO-)+c(OH-)
C.c(H+)=c(OH-)-c(CH3COOH)
D.2c(Ba2+)=c(CH3COO-)+c(CH3COOH))