1、选择题 已知通过乙醇制取氢气有如下两条路线:
a.CH3CH2OH(g)+H2O(g)==4H2(g)+2CO(g) △H= +255.6kJ·mol-1
b.CH3CH2OH(g)+1/2O2(g)==3H2(g)+2CO(g) △H= +13.8kJ·mol-1
则下列说法不正确的是
[? ]
A.降低温度,可提高b路线中乙醇的转化率
B.从能量消耗的角度来看,b路线制氢更加有利
C.乙醇可通过淀粉等生物原料发酵制得,属于可再生资源
D.由a、b知:2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
参考答案:A
本题解析:
本题难度:一般
2、选择题 下图表示可逆反应mA(g)+nB(g)? pC(g)在不同温度(T)、压强(p)下,生成物C的物质的量分数x(C)的变化情况.下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
pC(g)在不同温度(T)、压强(p)下,生成物C的物质的量分数x(C)的变化情况.下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
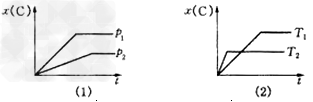
[? ]
A.放热反应,m+n>p
B.吸热反应,m+n>p
C.放热反应,m+n<p
D.吸热反应,m+n=p
参考答案:A
本题解析:
本题难度:一般
3、选择题 某温度下,反应N2O4(g)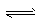 2NO2(g) △H>0,在密闭容器中达到平衡。下列说法不正确的是?
2NO2(g) △H>0,在密闭容器中达到平衡。下列说法不正确的是?
[? ]
A. 加压时(体积变小),将使正反应速率增大
B. 保持体积不变,升高温度,再达平衡时颜色变深
C. 保持体积不变,加入少许N2O4,再达到平衡时,颜色变深
D. 保持体积不变,加入少许NO2,将使正反应速率减小
参考答案:D
本题解析:
本题难度:一般
4、选择题 在一个不导热的密闭反应器中,只发生两个反应:a(g)+b(g)?2c(g)△H1<0;x(g)+3y(g)?2z?(g)△H2>0进行相关操作且达到平衡后(忽略体积改变所做的功),下列叙述错误的是( )
A.等压时,通入z气体,反应器中温度升高
B.等容时,通入z气体,y的物质的量浓度增大
C.等容时,通入惰性气体,各反应速率不变
D.等压时,通入惰性气体,c的物质的量不变
参考答案:A、等压时,通入z气体,第二反应平衡向逆反应移动,温度升高,导致第一个反应向逆反应移动,但移动结果不会恢复到原温度,故平衡时温度升高,故A正确;
B、等容时,通入z气体,第二反应平衡向逆反应移动,y的物质的量浓度增大,故B正确;
C、等容时,通入惰性气体,各反应混合物的浓度不变,各反应速率不变,故C正确;
D、等压时,通入惰性气体,体积增大,对第二个反应平衡向逆反应移动,温度升高,导致第一个反应向逆反应移动,c的物质的量减小,故D错误;
故选D.
本题解析:
本题难度:简单
5、填空题 在一定条件下,二氧化硫和氧气发生如下反应:
(1)600℃时,在一个密闭容器中,将二氧化硫和氧气混合,反应过程中SO2,O2,SO3的物质的量变化如 图所示,则反应处于平衡状态的时间是__________。
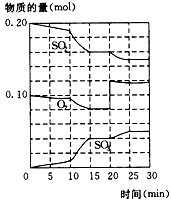
(2)据图判断,反应进行至20 min时,曲线发生变化的原因是_______(用文字表达)。
(3)10 min~15 min的曲线变化原因可能是________ (填写编号)。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加SO3的物质的量
参考答案:(1)15~20 min和25~30 min
(2)增加了O2的量
(3)AB
本题解析:
本题难度:一般