1、选择题 某化合物的结构式(键线式)及球棍模型如下:

该有机分子的核磁共振氢谱图如下(单位ppm)。
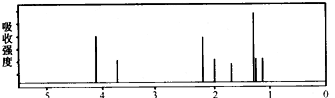
下列关于该有机物的叙述正确的是
[? ]
A.该有机物不同化学环境的氢原子有4种
B.该有机物属于芳香族化合物
C.键线式中的Et代表的基团为-CH3
D.该有机物在一定条件下能够发生取代反应
参考答案:D
本题解析:
本题难度:一般
2、选择题 从1L?3mol?L-1?的NaCl溶液中取出100mL溶液,则取出的溶液中含有NaCl的物质的量为
A.3?mol
B.0.3?mol
C.0.1?mol
D.5.85?g
参考答案:B
本题解析:分析:根据溶液为均一、稳定的混合物,可知1L溶液的浓度和100ml溶液的浓度相等,根据n=cV计算NaCl的物质的量.
解答:1L溶液的浓度和100ml溶液的浓度相等,则100mL溶液含NaCl的物质的量为:n=cV=0.1L×3mol/L=0.3mol,
故选B.
点评:本题考查物质的量浓度的计算,题目难度不大,注意溶液为均一、稳定的混合物,1L溶液的浓度和100ml溶液的浓度相等.
本题难度:困难
3、选择题 在下列各说法中,正确的是
A.ΔH>0表示放热反应,ΔH<0表示吸热反应
B.热化学方程式中的化学计量数只表示物质的量,可以是分数
C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
参考答案:B
本题解析:A项,ΔH>0表示吸热反应,ΔH<0表示放热反应;C项,“中和热”是指在稀溶液中,酸和碱发生中和反应,生成1 mol水时放出的热量,1 mol H2SO4与1 mol Ba(OH)2反应生成2 mol水,放出的热大于中和热;D项,在101 kPa时,1 mol H2与0.5 mol O2反应,生成液态水时放出的热才是H2的燃烧热,题中没有说明生成的水的聚集状态。
本题难度:一般
4、选择题 下列实验所用试剂错误的是
A.检验乙炔中是否混有H2S:湿的醋酸铅试纸
B.盐酸滴定NaHCO3溶液:酚酞作指示剂
C.检验淀粉是否完全水解:碘水
D.检验氯化氢是否集满:湿的蓝色石蕊试纸
参考答案:B
本题解析:分析:要检验某种物质是否存在,应加入某种试剂使其反应产生特殊的现象,从而达到实验目的,据此分析解答.
解答:A.湿的醋酸铅试纸能和硫化氢反应生成黑色的硫化铅,醋酸铅和乙炔不反应,所以能达到实验目的,故A正确;
B.碳酸氢钠溶液的pH在8左右,酚酞的变色范围也是8左右,所以用盐酸滴定碳酸氢钠时用酚酞作指示剂变色不明显,一般使用甲基橙作指示剂,故B错误;
C.淀粉溶液遇碘变蓝色,而葡萄糖和碘不反应,所以可以用碘水检验淀粉是否完全水解,故C正确;
D.盐酸能使蓝色石蕊试纸变红色,所以可以用湿的蓝色石蕊试纸检验氯化氢是否收集满,故D正确;
故选B.
点评:本题考查物质的检验,明确物质的性质是解本题关键,难度不大.
本题难度:困难
5、选择题 用NA表示阿伏加德罗常数,下列叙述不正确的是
A.标准状况下,22.4?L?H2含有的分子数为1?NA
B.常温常压下,1.06?g?Na2CO3含有的Na+离子数为0.02?NA
C.常温常压下,48?g?O2和?O3的混合物所含的氧原子数为3?NA
D.物质的量浓度为0.5?mol/L的MgCl2溶液中,含有Cl-个数为1?NA
参考答案:D
本题解析:分析:A、依据气体摩尔体积换算物质的量计算判断;
B、质量换算物质的量结合碳酸钠构成计算分析;
C、依据氧气和臭氧都是氧原子构成,只需要计算氧原子物质的量计算分析判断;
D、溶液体积不知,不能计算微粒数目.
解答:A、标准状况下,22.4?L?H2物质的量为1mol,含有的分子数为1?NA,故A正确;
B、常温常压下,1.06?g?Na2CO3物质的量为0.01mol,含有的Na+离子数为0.02?NA,故B正确;
C、常温常压下,48?g?O2和?O3的混合物中含氧原子物质的量=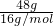 =3mol,所含的氧原子数为3?NA,故C正确;
=3mol,所含的氧原子数为3?NA,故C正确;
D、物质的量浓度为0.5?mol/L的MgCl2溶液中,溶液体积不知,不能计算微粒数目,故D错误;
故选D.
点评:本题考查了气体摩尔体积的体积应用,质量换算物质的量计算微粒数,浓度与微粒数计算关系.
本题难度:简单