1、选择题 已知对角线规则为:沿周期表中金属与非金属分界线方向对角的两主族元素性质相似,如Li与Mg,Be与Al,B和Si相似,则下列叙述中不正确的是
A.BeO为两性氧化物
B.Be(OH)2难溶于水
C.H3BO3是难溶于水的弱酸
D.B2O3既能溶于强酸又能溶于强碱
参考答案:D
本题解析:元素周期表中,处于对角线位置的元素具有相似的性质,则根据Al、Al2O3、Al(OH)3的性质可知:
A.Be与Al处于对角线位置,性质相似,已知Al2O3为两性氧化物,则BeO为两性氧化物,故A正确;
B.Be与Al处于对角线位置,性质相似,已知Al(OH)3难溶于水,则Be(OH)2难溶于水,故B正确;
C.Al(OH)3具有两性,其中HAlO2为难溶于水的弱酸,则H3BO3是难溶于水的弱酸,故C正确;
D.B和Si处于对角线位置,性质相似,SiO2不溶于强酸,则B2O3也不溶于强酸,故D错误。
故选D。
点评:本题考查元素周期表和周期律的关系,题目难度中等,注意对角线原则,把握常见元素化合物的性质。
本题难度:简单
2、填空题 (12分)下表列出了A~R 9种元素在周期表中的位置:
族
周期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0
|
二
| ?
| ?
| ?
| E
| ?
| F
| ?
| ?
|
三
| A
| C
| D
| ?
| ?
| ?
| G
| R
|
四
| B
| ?
| ?
| ?
| ?
| ?
| H
| ?
|
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为?。
(2)地壳中含量最多的非金属元素是?(用元素符号填空)。
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是 ?,碱性最强的是?,呈两性的氢氧化物是?(用化学式填空)。
(4)写出D与氢氧化钠溶液反应的化学方程式: ? 。
参考答案:(12分)(1)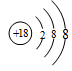 (2)O? (3)HClO4 , KOH?, Al(OH)3
(2)O? (3)HClO4 , KOH?, Al(OH)3
(4)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
本题解析:考查元素周期表的结构及元素周期律的应用。根据元素在周期表中的位置可知,A~R 9种元素分别是Na、K、Mg、Al、C、O、Cl、Br、Ar。稀有气体分子的最外层电子已经达到稳定结构,所以Ar的性质最不活泼。金属性越强最高价氧化物的水化物的碱性越强,同样非金属性越强,最高价氧化物的水化物的酸性越强。所以分别是高氯酸和氢氧化钾。
本题难度:一般
3、填空题 (4分)氧族元素位于周期表中?族,它们的最外层电子数为?,该族元素随着核电荷数的递增,半径逐渐??,非金属性逐渐?。
参考答案:VIA? 6?增大减弱
本题解析:略
本题难度:一般
4、选择题 第119号某未知元素,有人称之为“类钫”。根据周期表结构及元素性质的变化趋势,下列有关“类钫”的预测说法错误的是(? )
A.“类钫”在化合物中呈+1价
B.类钫具有放射性
C.单质与水反应较为缓慢
D.类钫最高价氧化物对应的水化物是强碱
参考答案:C
本题解析:119―2-8-8-18-18-32-32=1,所以该元素应该位于第八周期,第IA。同主族元素自上而下金属性逐渐增强,所以选项C是错误的。答案C。
本题难度:简单
5、填空题 现有A、B、C、D、E、F六种短周期元素,原子序数依次增大。已知A与D、C与E
分别同主族,D、E、F同周期。A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C可形成电子总数相等的分子,且A与C、A与E、A与F也可以形成电子总数相等的分子。
请回答下列问题:
(1)元素F在周期表中的位置________________________________________________。
(2)A、C、D三种元素可组成一种常见化合物,该化合物的化学式为________;工业生产该化合物和单质F的离子方程式为_________________________________________。
(3)B与F形成的化合物分子中,各原子最外层均达8电子结构,则该分子的电子式为________________________________________________________________________。
(4)已知0.50 mol EC2被C2氧化成气态EC3,放出49.15 kJ热量,其热化学方程式为_________________________________________________________________________。
(5)A、B、C以原子个数比4∶2∶3所形成的化合物,所含的化学键类型为____________。
0.1 mol·L-1该化合物水溶液中的离子浓度由大到小的顺序为_________________________________________________________。
参考答案:(1)第三周期第Ⅶ A族
(2)NaOH2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
(3)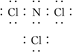
(4)2SO2(g)+O2(g)=2SO3(g)ΔH=-196.6 kJ·mol-1(或SO2(g)+1/2O2(g)=SO3(g)ΔH=-98.3 kJ·mol-1)
(5)离子键和(极性)共价键 c(NO3-)>c(NH4+)>c(H+)>c(OH-)
本题解析:短周期元素形成电子总数相等的分子,不是10电子分子,就是18电子分子;A分别与B、C可形成电子总数相等的分子,该分子是10电子分子;A与C、E、F也可以形成电子总数相等的分子,则该分子只能为18电子分子;A元素为氢元素,C元素为氧元素,则B元素为氮元素,D元素为钠元素,E元素为硫元素,F为氯元素。
(1)元素F(氯)在周期表中的位置是第三周期第ⅦA族。
(2)A、C、D三种元素可组成的一种常见化合物为NaOH,工业上生产该化合物和单质F(Cl2)的方法为电解饱和食盐水,其离子方程式为2Cl-+2H2O Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
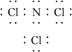 (3)B与F形成的化合物分子NCl3中,氮原子最外层5个电子,需要3个电子使原子最外层达8电子结构,氯原子最外层7个电子,需要1个电子使原子最外层达8电子结
(3)B与F形成的化合物分子NCl3中,氮原子最外层5个电子,需要3个电子使原子最外层达8电子结构,氯原子最外层7个电子,需要1个电子使原子最外层达8电子结
构,则该分子的电子式为?。
(4)0.50 mol SO2被O2氧化成气态SO3,放出49.15 kJ热量,则1.0 mol SO2被O2氧化成气态SO3放出98.3 kJ热量,2.0 mol SO2被O2氧化成气态SO3,放出196.6 kJ热量,热化学方程式为2SO2(g)+O2(g)=2SO3(g) ΔH=-196.6 kJ·mol-1或SO2(g)+1/2O2(g)=SO3(g)ΔH=-98.3 kJ·mol-1。
(5)A、B、C以原子个数比4∶2∶3所形成的化合物为NH4NO3,属于盐类,为离子化合物,所含的化学键类型为离子键和(极性)共价键;NH4NO3是一种强酸弱碱盐,水溶液呈酸性,离子浓度由大到小的顺序为c(NO3-)>c(NH4+)>c(H+)>c(OH-)。
本题难度:一般