1、填空题 有A、B、C、D四种短周期的非金属元素(其单质也可分别用A、B、C、D表示),四种元素的原子序数按B、D、C、A顺序增大,D、C元素在周期表中位置相邻。在一定条件下,B可以分别和A、C、D化合生成甲、乙、丙化合物,C和D化合可得丁。已知乙、丙两个分子中各含有10个电子,并且甲、乙、丙、丁、戊有如下的变化关系:

请填写下列空格:
(1)甲的浓溶液与一种黑色粉末共热可得A,该反应的离子方程式为:
__________________________________________________________。
(2)写出下列化学用语:用电子式表示乙分子的形成过程_______________,
戊分子的结构式是__________,甲和丙反应产物的电子式 __________。
(3)写出下列反应的化学方程式:
丙+丁→D + 乙:_____________;A+丙→D + 甲:__________________
参考答案:(1)MnO2 + 4HCl(浓) 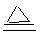 ?MnCl2 + Cl2↑ + 2H2O?(2分)
?MnCl2 + Cl2↑ + 2H2O?(2分)
(2)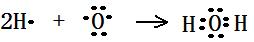 ?(2分), H-O-Cl (2分),NH4Cl的电子式略 (2分)
?(2分), H-O-Cl (2分),NH4Cl的电子式略 (2分)
(3)4NH3 + 6NO = 5N2 + 6H2O (2分)? 3Cl2 + 2NH3 = N2 + 6HCl?(2分)
本题解析:略
本题难度:一般
2、推断题 某些物质的转化关系如下图所示(不是所有的产物都标出)。已知:
① 若用两根玻璃棒分别蘸取A的浓溶液和浓盐酸并使它们接近时,有大量白烟生成;
② 甲是由两种单质直接化合得到的一种淡黄色固体;
③ 乙为一种金属单质,常温下,它在浓硝酸钝化;
④ D溶液呈碱性,F为溶液。
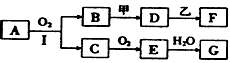
(1)A属于___________ A、电解质 B、非电解质
(2)请写出C、G的化学式: C____________ G________________
(3)请写出B与甲反应的化学方程式___________________________________,该反应中的氧化剂是___________(填化学式),还原剂是___________(填化学式);
(4)请写出D溶液与乙反应的化学方程式________________________________。
参考答案:(1)B
(2)NO;HNO3
(3)2Na2O2 + 2H2O === 4NaOH + O2↑;Na2O2;Na2O2
(4)2Al+2NaOH+2H2O===2NaAlO2+3H2↑
本题解析:
本题难度:一般
3、推断题 物质A有如下图所示转化关系,其中乙为金属单质,常温下,它在G 的浓溶液中发生钝化, F 的溶液中只含有一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。请讨论以下两种情况(注:两种情况下各字母代表的物质可能不同)
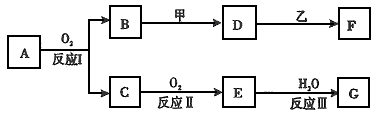
回答下列问题:
(l)第一种情况:用两根玻璃棒分别蘸取 A、G的浓溶液并使它们接近时,有大量白烟生成;甲为焰色反应呈黄色的金属单质; D 和 F 的溶液均呈碱性。
则: ①反应Ⅲ的化学方程为________________。
②D与乙反应的离子方程式为________________ 。
(2)第二种情况: 甲由两种单质直接化合得到;B 为红棕色固体; C为无色气体,是形成酸雨的大气污染物之一;D 的水溶液加入用硝酸酸化的AgNO3溶液有白色沉淀生成。
则: ①工业上,反应 I的化学方程式为________________ 生产设备名称为:__________
②D和乙反应的离子方程式为______________________
③ 请简述检验D溶液中阳离子的方法_________________ 。
④ 若A的相对分子质量为120,反应Ⅰ、Ⅱ、Ⅲ均为完全转化。现取m克含A及少量杂质的样品,按上述过程充分反应后(杂质不参与反应),得到密度为ρg/cm3,溶质质量分数为a% 的G溶液n mL。则该样品中A的质量分数=_____________ (列出计算式即可)。
参考答案:(1)①3NO2+H2O==NO+2HNO3
②2Al+2OH-+2H2O?== 2AlO2-+3H2↑
(2)① 4FeS2+11O2==2Fe2O3+8SO2(反应条件:高温); 沸腾炉?
②2Fe3+ + Fe ==3Fe2+?
③取少量G溶液于一试管中,向其中滴入1~2滴硫氰化钾溶液,溶液呈现红色、则有三价铁离子?
④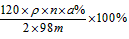
本题解析:
本题难度:一般
4、填空题 A、B、C、D、E五种常见化合物,都是由下面中的离子形成的:阳离子:K+、Na+、Al3+、Fe3+?阴离子:HCO3—、SO42—、OH-、 Cl—
为了鉴别上述化合物,分别完成以下实验,其结果是:
① 将它们溶于水后,A为棕黄色溶液,其他均为无色溶液;
② 将它们进行焰色反应,仅有C、E为紫色(透过蓝色钴玻璃);
③ 将B溶液滴人到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
④ 在各溶液中加入硝酸钡溶液,再加过量稀硝酸,只有D中放出无色气体,只有A、C中产生白色沉淀;
⑤ 将A、E两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出的化学式:A?____,C?。
(2)写出B和D反应的离子方程式?。
(3)进行焰色反应实验操作时,使用铂丝前应该用________洗涤。
(4)在D溶液中加入少量澄清石灰水,其离子方程式为__?__
(5)向100mL 1mol/L C溶液中加入0.2 molBa(OH)2溶液,充分反应后得到溶质是??
参考答案:(8分)(方程式2分,其余各1分)
(1)Fe2(SO4)3?; KAl(SO4)2?
(2) HCO3-+OH-==H2O+CO32-?(3)HCl
(4)Ca2++2HCO3-+2OH-==CaCO3+2H2O+CO32-?(5)Na[Al(OH)4
本题解析:①说明A中有三价铁离子,②说明C、E中有钾离子,③白色沉淀溶解,可能生成的沉淀为氢氧化铝,④确定A、C中有硫酸根离子,D中有碳酸氢根离子,⑤A与E不反应,说明E是氯化钾溶液。综上所述,A为硫酸铁,C为硫酸铝钾,B为氢氧化钠,D为碳酸氢钠,E为氯化钾。
点评:本题涉及到了很多常见离子的检验,比如氯离子,硫酸根离子,碳酸根离子,钾离子等。学生需要在平时多积累常见离子的检验方法,并且要具备一定的推理能力。
本题难度:一般
5、填空题 一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如下列框图所示。
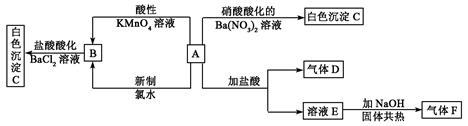
其中A为正盐,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝。试回答下列问题:
(1) 写出下列物质化学式:A:_________________;C:_________________;
写出下列物质化学式:A:_________________;C:_________________;
(2)写出E的电子式_____________;F的结构式__________________
(3)写出下列反应的 离子方程式:
离子方程式:
①由B生成C:________________________________________________________
②A和新制氯水反应:___________________________________________________。
参考答案:(每空2分,共12分)
(1)(NH4)2SO3 ?BaSO4
(2)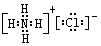 ?
?
(3)Ba2++ SO42—= BaSO4↓? SO32—+Cl2+H2O = SO42—+2H++2Cl—
本题解析:略
本题难度:简单