1、填空题 下列框图中的物质均为中学化学中常见物质,其中甲、乙为单质,其余均为化合物。B为常见液态化合物,A为淡黄色固体,将G的饱和溶液滴入沸水中,煮沸可得到红褐色胶体。请回答下列问题:
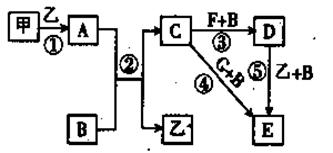
(1)A的电子式为?,乙的组成元素在周期表中的位置是?
(2)反应①~⑤中,属于非氧化还原反应的是?(填序号);C中含有的化学键有?(填序号:a离子键; b极性键 ;c 非极性键)
(3)反应⑤的化学方程式为?;甲与B反应的离子方程式为?。
(4)F溶液中阳离子的检验方法为?
(5)在F溶液中加入与F等物质的量的A恰好使F转化为E,写出该反应的离子方程式?。
2、填空题 (16分)下图所示各物质是由1~20号元素中部分元素组成的单质或化合物,图中部分反应条件未列出。已知D、L、M为气体单质,C、E、H为气体化合物,反应②、④、⑥是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法。
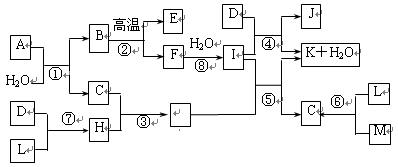
请回答下列问题:
(1)物质E的结构式为 __________。
(2)属于化合反应,但不属于氧化还原反应的是__________(用编号填空)。
(3)C、H的熔沸点比较:C___H(填““>”、“<”或“=”))原因是:________________。
(4)物质A由三种元素组成,1molA与水反应可生成1molB和2molC,A的化学式为
______________。
(5)在一定温度下,有甲、乙 两容积相等的密闭容器。
两容积相等的密闭容器。
I.向甲容器中通入3 mol M和4 mol L,反应达到平衡时,生成C的物质的量为a mol。此时,M的转化率为__________。下列能提高反应物L的转化率,但实际生产过程中并没有采用的措施是_____________。
①降低合成塔温度?②适当增大压强
③不断分离出产物C?④加入合适催化剂
II.向乙中通入2 mol C,欲使反应达到平衡时,各物质的浓度与I中第一次平衡时相同,则起始时还需通入__________mol M和__________mol L。
III.若起始时,向乙中通入6mol M和8mol L,达到平衡时,生成C的物质的量为b mol,
则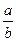 ? ________
? ________ 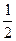 (选填“>”、“<”或“=”)。
(选填“>”、“<”或“=”)。
3、简答题 A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示.

请回答下列问题:
(1)X的单质与A反应的化学方程式是______.
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是______.
(3)若试剂1和试剂2均是稀硫酸.
①检验物质D的溶液中金属离子的方法是______.
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示)______.
③某高效净水剂是由Y(OH)S04聚合得到的.工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是______.
4、填空题 (15分)A、B、C、D均为中学所学的常见物质且均含有同一种元素,它们之间的转化关系如下图所示(反应条件及其他物质已经略去):
A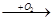 B
B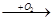 C
C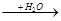 D
D
(1)若A、D的水溶液均能使湿润的蓝色石蕊试纸变红,则A、D分别为(填写化学式)。
A ?,D?。
(2)若A的水溶液能使湿润的红色石蕊试纸变蓝,D的稀溶液能使蓝色的湿润石蕊试纸变红,则A为?。写出A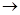 B转化的化学方程式:?。
B转化的化学方程式:?。
(3)若A为活泼金属元素的单质,D为强碱,焰色反应显黄色,则A是??,
B是?,C是?。C可作为呼吸面具的填充剂,C与二氧化碳发生反应的化学方程式为:?。A跟水发生反应的化学方程式??。
(4)若A为常见的非金属单质,则A有多种情况,请填写下表,并完成相应的化学反应方程式。(可以不填满,也可以补充)
编号
| A
| ·? B—C化学方程式
|
①
| ?
| ?
|
②
| ?
| ?
|
③
| ?
| ?
5、填空题 (7分)A、B、C、D均为中学化学常见的物质。它们之间存在如下图所示的转化关系时。

(1)若A为Cl2,B为Ca(OH)2,常温下反应的化学方程式为:
______________?________________________
该反应的还原剂是?
若有1molCl2参加反应,则反应中转移的电子数为?
(2)若A为单质,C、D均为能使澄清石灰水变浑浊的无色气体,B的化学式为?。
|