1、选择题 实验室用溴和苯在FeBr3催化下制取溴苯,得到粗溴苯后,要用如下操作提纯:(1)蒸馏;(2)水洗;(3)用干燥剂干燥;(4)用10%的NaOH溶液洗涤。正确的操作顺序是(?)
A.(1)(2)(3)(4)
B.(4)(2)(3)(1)
C.(4)(1)(2)(3)
D.(2)(4)(2)(3)(1)
参考答案:D
本题解析:制取的溴苯中主要混有挥发出来的苯和溴,苯和溴苯的沸点相差比较大,可通过蒸馏分离。溴可溶于水而溴苯不溶于水,因此可先通过水洗除去大部分溴,然后再用氢氧化钠除去剩余的溴。最后通过干燥蒸馏使溴苯和苯分离。答案是D。
本题难度:一般
2、选择题 下列实验能达到预期目的的是
A.从含I-的溶液中提取碘:加入硫酸酸化的H2O2溶液,再用酒精萃取
B.检验溶液中是否一定含有CO32-:滴加稀盐酸,将产生的气体通入澄清石灰水
C.检验蔗糖水解产物是否有还原性:向水解后的溶液中加入新制Cu(OH)2并加热
D.除去粗盐溶液中的Ca2+、SO42-:依次加入过量的BaCl2溶液、Na2CO3溶液,过滤后再加适量盐酸
参考答案:D
本题解析:从含I-的溶液中提取碘:加入适量稀硫酸与3%的H2O2溶液,应用CCl4萃取,不能用酒精萃取,酒精与水互溶;A选项不正确,检验溶液中是否含有CO32-:滴加稀盐酸,将产生的气体通入澄清石灰水,可能有HCO3-、SO32-、HSO3-等干扰;B选项不正确,检验蔗糖水解产物:向蔗糖溶液中加入适量稀硫酸水浴加热后,应先加NaOH中和到中性或弱碱性,再加入新制的Cu(OH)2悬浊液,加热至沸腾。C选项不正确,除去粗盐中的Ca2+、SO42-及泥沙,盐酸要放在最后,来除去过量的碳酸钠,要先加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除过量的钡离子.D选项正确。
本题难度:一般
3、选择题 亚硝酸钠外观与食盐相似,生活中若误食亚硝酸钠会导致中毒。下列方法不能用来鉴别亚硝酸钠和食盐的是
A.将两种固体分别溶于水配成溶液,在酸性条件下加入KI淀粉溶液
B.将两种固体分别溶于水配成溶液,在酸性条件下加入FeCl2溶液
C.将两种固体分别溶于水配成溶液,加入AgNO3溶液
D.将两种固体分别溶于水配成溶液,加入稀硫酸并微热
参考答案:C
本题解析:略
本题难度:简单
4、选择题 下列试剂中,可用于硬水软化的是( )
A.明矾
B.液氯
C.漂白粉
D.磺化煤
参考答案:A.明矾溶解于水形成胶状物,能吸附不溶的杂质小颗粒沉降下来,而硬水与软水的区别是可溶性钙、镁化合物的含量不同,与不溶性杂质无关,故A错误;
B.液氯为单质,溶于水变成氯水,氯水中含有HClO,具有漂白性,能杀菌消毒,但与硬水与软水的区别是可溶性钙、镁化合物的含量不同无关,故B错误;
C.漂白粉的成分是氯化钙和次氯酸钙的混合物,漂白原理是次氯酸钙和弱酸性物质生成的次氯酸的漂白性,能杀菌消毒,但与硬水与软水的区别是可溶性钙、镁化合物的含量不同无关,故C错误;
D.磺化煤(NaR)是一种有效的离子交换剂,加入磺化煤,离子交换法中阳离子交换剂发生含H+、Na+固体与Ca2+、Mg2+离子交换,可将硬水软化,发生反应为2NaR+CaSO4→CaR2+NaSO4、2HR+CaSO4→CaR2+NaSO4,故D正确;
故选D.
本题解析:
本题难度:简单
5、实验题 现有含有少量NaCl、Na2SO4、Na2CO3等杂质的NaNO3溶液,选择适当的试剂除去杂质,得到纯净的NaNO3固体,实验流程如下图所示。
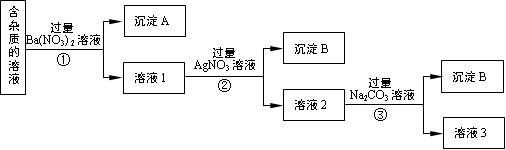
(1)沉淀A的主要成分是?、?(填化学式)。
(2)②中反应的离子方程式是?。
(3)①②③中均进行的分离操作是?。
(4)③中加入过量的Na2CO3溶液的目的是?。
(5)溶液3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是?,为了除去杂质,可向溶液3中加入适量的?。
(6)实验室用上述实验获得的NaNO3固体配制500 mL 0.40 mol/L NaNO3溶液。
①配制溶液时,进行如下操作:a.定容;b.计算;c.溶解;d.摇匀;e.转移;f.洗涤;j.称量。称取NaNO3固体的质量是??g。按照操作顺序,第4步是?(填序号)。
②某同学转移溶液的操作如图所示,图中仪器的名称是烧杯和?,该同学操作中的错误是?。

参考答案:(1)BaSO4? BaCO3
(2)Ag++ Cl—="=" AgCl↓
(3)过滤
(4)除去Ba2+、Ag+
(5)Na2CO3或CO32—?稀硝酸
(6)①17.0? e?②500mL容量瓶?未用玻璃棒引流
本题解析:(1)向含有杂质的NaNO3溶液溶液中加入过量的Ba(NO3)2,发生反应:Na2SO4+ Ba(NO3)2= BaSO4↓+ 2NaNO3;Na2CO3+ Ba(NO3)2= BaCO3↓+ 2NaNO3沉淀A的主要成分是BaSO4、BaCO3。(2)溶液1中含有NaCl、NaNO3、过量的Ba(NO3)2,向其中加入过量的Ag NO3溶液,发生反应:NaCl +Ag NO3= AgCl↓+ NaNO3,离子方程式为:Ag++ Cl—="=" AgCl↓。(3)①②③中都是分离难溶性固体与液体的操作,均进行的分离操作是过滤。(4)向溶液2中加入过量的Na2CO3溶液,发生反应:Ba(NO3)2+ Na2CO3= BaCO3↓+ 2NaNO3,2AgNO3+ Na2CO3= Ag2CO3↓+ 2NaNO3.所以③中加入过量的Na2CO3溶液的目的是除去Ba2+、Ag+。(5)由于③加入过量的Na2CO3溶液,所以3经过处理可以得到NaNO3固体,溶液3中肯定含有的杂质是Na2CO3,为了除去杂质,可向溶液3中加入适量的稀硝酸。(6)①配制溶液时,称取NaNO3固体的质量是0.5L ×0.40 mol/L×85g/mol=17.0g.按照操作顺序,第4步是e.转移.②某同学转移溶液的操作如右图所示,图中仪器的名称是烧杯和500mL容量瓶;该同学操作中的错误是未用玻璃棒引流。
本题难度:一般