1、实验题 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算。

(1)该小组设计了如上图所示的实验装置,检查该装置气密性的操作是________________。
(2)若在烧瓶中放入1.30 g锌粒,与c mol/L H2SO4反应,为保证实验结论可靠,量气管的适宜规格是(填字母)____。
A.100 mL B.200 mL C.400 mL D.500 mL
(3)若1.30 g锌粒完全溶解,氢氧化钠洗气瓶增重0.64 g(烧瓶中残留气体忽略不计,下同),则圆底烧 瓶中发生反应的化学方程式为______________________。
(4)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重bg,量气管中收集到V mL气体(标准状况),请用一个代数式表示出a、b、V之间的关系___________。
(5)若撤走盛有无水氯化钙的U形管,则n(H2)/n(SO2)的数值将____(填“偏大”、“偏小”或 “无影响”)。
(6)反应结束后,为了准确地测量气体体积,读数时应注意的事项是:_________、__________
参考答案:(1)关闭分液漏斗活塞,向右侧球形管中加入水,一段时间后观察球形管和量气管之间的液面差有无变化
(2)D
(3)Zn+2H2SO4=ZnSO4+SO2↑+2H2O、Zn+H2SO4=ZnSO4+H2↑或2Zn+3H2SO4=2ZnSO4+SO2↑+H2↑+2H2O
(4)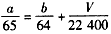
(5)偏小
(6)①待冷却至室温再开始读数;②读数前使量气管左右液面相平(或眼睛视线与液面最低处相平)
本题解析:
本题难度:一般
2、实验题 某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。
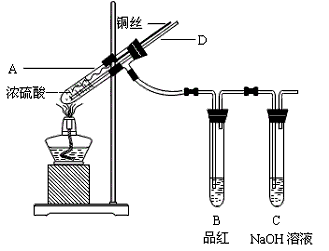
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为_________________。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是____________。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是________________________。
【实验2】实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜。
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜。
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫。
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图所示的实验:
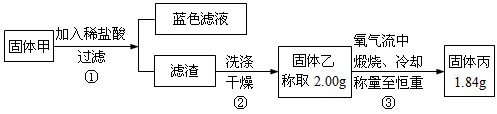
(4)②中检验滤渣是否洗涤干净的实验方法是___________。
(5)③中在煅烧过程中一定发生的反应的化学方程式为_____________________。
(6)下列对于固体甲的成分的判断中,正确的是(填字母选项)____________。
A.固体甲中,CuS和Cu2S不能同时存在
B.固体甲中,CuO和Cu2O至少有一种
C.固体甲中若没有Cu2O,则一定有Cu2S
D.固体甲中若存在Cu2O,也可能有Cu2S
参考答案:(1)2H2SO4(浓)+Cu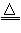 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)试管A中气体压强减小,空气从D导管进入试管A中
(3)从D管口向A中大量鼓气
(4)取最后一次洗涤后所得液体于试管中,滴加硝酸银溶液,若无白色沉淀产生,则说明沉淀洗涤干净,若有白色沉淀生成,则说明未洗干净
(5)2CuS+3O2 2CuO+2SO2 (条件也可为“煅烧”)
2CuO+2SO2 (条件也可为“煅烧”)
(6)BCD
本题解析:
本题难度:困难
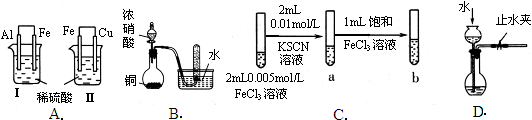
3、选择题 根据下列实验现象,所得结论错误的是
实验
| 实验现象
| 结论
|
A
| Ⅰ烧杯中铁片表面有气泡,Ⅱ烧杯中铜片表面有气泡
| 活动性:Al>Fe>Cu
|
B
| 试管中收集到无色气体
| 铜与浓硝酸反应产物是NO
|
C
| 试管b比试管a中溶液的红色深
| 增大反应物浓度,平衡向正反应方向移动
|
D
| 长颈漏斗内液面高于烧瓶内液面且保持不变
| 装置气密性良好
|
?
参考答案:B
本题解析:A、根据原电池的工作原理,左烧杯中铁表面有气泡,说明负极为铝,正极为铁,金属活动性Al>Fe,右边烧杯中铜表面有气泡,说明铁为负极,铜为正极,金属活动性Fe>Cu,则活动性为Al>Fe>Cu,故A正确;B、Cu与浓硝酸反应,反应中的化合价变化为:HNO3中N元素由+5价降低为NO2中N元素+4价,HNO3是氧化剂,NO2是还原产物,方程式为:Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O;生成的红棕色二氧化氮和水发生氧化还原反应,3NO2+H2O=2HNO3+NO,所以图中试管中收集到无色气体为一氧化氮,但不是铜和浓硝酸反应生成一氧化氮,故B错误;C、Fe3+遇SCN-发生反应Fe3++3SCN-?Fe(SCN)3,Fe(SCN)3为血红色,增大氯化铁溶液的浓度,根据溶液颜色变化来判断反应方向,如果溶液颜色加深,则说明平衡向正反应方向移动,所以能达到实验目的,故C正确;D、该装置的气密性检查,主要是通过气体压强增大看体积变化来进行检验,夹紧止水夹,向长颈漏斗中加水至其液面高于烧瓶内的液面,一段时间后,看液面高度差有无变化,变化说明装置漏气,反之不漏气,故D正确。
本题难度:一般
4、选择题 有关物质的检验,以下说法正确的是( )
A.向某溶液中滴加AgNO3溶液,生成白色沉淀,说明原溶液中含有Cl-
B.某气体可以使燃着的木条熄灭,说明该气体是CO2
C.加入盐酸,放出能使澄清石灰水变浑浊的无色无味的气体,不一定是含有CO32-
D.向某溶液中滴加BaCl2溶液,有白色沉淀产生,说明原溶液中一定存在CO32-或者SO42-
参考答案:A、向某溶液中滴加AgNO3溶液,生成白色沉淀,说明原溶液中含有Cl-或是CO32-等离子,故A错误;
B、某气体可以使燃着的木条熄灭,说明该气体是CO或是CO2中的至少一种,故B错误;
C、加入盐酸,放出能使澄清石灰水变浑浊的无色无味的气体,则溶液中可以含有碳酸根离子、碳酸氢根离子、亚硫酸根离子或是亚硫酸氢根离子中的至少一种,故C正确;
D、向某溶液中滴加BaCl2溶液,有白色沉淀产生,说明原溶液中存在CO32-、SO42-、Ag+中的至少一种,故D错误.
故选C.
本题解析:
本题难度:一般
5、实验题 ( 17分)欲配制1 mol/L的氢氧化钠溶液250mL,
(1)实验室所需的仪器有:?,?,?,?,?。
(2)完成下列步骤:
①称取氢氧化钠固体?克。
②将称好的氢氧化钠固体放入?中,加少量蒸馏水将其溶解,待冷却后将溶液沿?移入?中。
③用少量蒸馏水洗涤?次,将洗涤液转移入?中,在操作过程中不损失点滴液体,否则会使溶液的浓度偏?(高或低)。
④加水定容过程中离刻度线?时,改用?小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度偏?,应该?。
⑤最后盖好瓶盖,?,将配好的溶液移入试剂瓶中并贴好 91eXAm.org标签。
参考答案:(1):托盘天平,烧杯,玻璃棒,250ml容量瓶,胶头滴管
(2):10.0g?烧杯?玻璃棒? 250ml容量瓶? 2-3次?容量瓶?低
1-2cm?胶头滴管?低?重新配置?摇匀?试剂瓶
本题解析:略
本题难度:一般