1、选择题 常温时,将500 ml pH=a的CuSO4和K2SO4的混合溶液用石墨电极电解一段时间,测得溶液的pH变为b(假设溶液体积的变化忽略不计),在整个电解过程中始终发现只有一个电极有气体产生。下列说法错误的是(?)
A.若使溶液恢复到电解前的浓度可以向溶液中加20(10-b-10-a)g CuCO3
B.b<a<7
C.阳极电极反应:2H2O—4e—=O2↑+4H+
D.整个过程中是阳极产生氧气,阴极析出铜单质
参考答案:A
本题解析:
本题的关键是看到在整个电解过程中始终发现只有一个电极有气体产生,马上就知道整个过程中是阳极产生氧气,阴极析出铜单质,要恢复电解前的溶液就要将氧气和铜的质量转化成CuO或CuCO3,需要20(10-b-10-a)g CuO。考虑水解a<7,电解转变成酸则b<a。
本题难度:一般
2、填空题 (18分)如图装置中,A、B两池溶液的体积均为200mL,
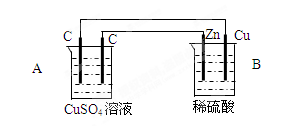
⑴判断装置的名称:A池为??B池为?
⑵A池中左边石墨棒为?极,电极反应式为??
A池中电池总反应式??
(3)若工作一段时间后,B池中Cu棒上析出224ml气体(标准状态),则电路中通过
了?mol电子,B池中溶液质量?(填“增加”、“不变”或“减少”)??g,若反应前后溶液的体积不变,反应后A池溶液的pH为?
参考答案:(1)电解池,原电池
(2)阳,4OH--4e-=2H2O+O2↑? 2H2O+2CuSO4 2Cu+O2↑+2H2SO4?
2Cu+O2↑+2H2SO4?
(3)0.02,?增加,? 0.63,? 1?(每空2分)
本题解析:(1)锌能和稀硫酸反应,所以根据装置可知,A是电解池,B是原电池。
(2)锌比铜活泼,所以锌是负极,铜是正极,则A池中左边石墨棒为阳极,溶液中的OH-放电,方程式为4OH--4e-=2H2O+O2↑。惰性电极电解硫酸铜溶液的方程式为2H2O+2CuSO4 2Cu+O2↑+2H2SO4。
2Cu+O2↑+2H2SO4。
(3)B池中Cu棒上析出的气体是氢气,物质的量是0.01mol,所以转移电子是0.02mol。B中的总反应式为Zn+2H+=Zn2++H2↑,所以B池中溶液质量增加0.65g-0.02g=0.63g。根据电子得失守恒可知,A中产生的氢离子是0.02mol,其浓度是0.02mol÷0.2L=0.1mool/L,所以pH=1。
本题难度:一般
3、选择题 金属的防护可分为物理方法和化学方法,例如:①刷漆;②在轮船船身上连接锌块;③包塑料层;④涂油脂;⑤镀上不活泼金属;⑥在地下钢铁管道上连接镁块。其中属化学方法的是
[? ]
A.②⑥
B.①③④
C.②⑤⑥
D.全部
参考答案:A
本题解析:
本题难度:简单
4、选择题 下列条件下铁钉最容易生锈的是
A.浸泡在海水中
B.浸泡在植物油中
C.置于干燥的空气中
D.浸泡在蒸馏水中
参考答案:A
本题解析:铁钉浸泡在海水中,将构成原电池,而原电池能加快反应速率,故最容易生锈;
本题难度:简单
5、选择题 钢铁发生吸氧腐蚀时,正极上发生的电极反应是(?)
A.2H++2e-===H2
B.Fe2++2e-===Fe
C.2H2O+O2+4e-===4OH-
D.Fe3++e-===Fe2+
参考答案:C
本题解析:钢铁发生吸氧腐蚀时正极是氧气得到电子,答案选C。
点评:该题属于基础性试题,难度不大,只要熟练记住吸氧腐蚀和析氢腐蚀的区别,即不难得出结论。
本题难度:简单