1、选择题 下列说法正确的是( )
A.镀锌铁的镀层破损后,镀层仍然对铁起保护作用
B.SiO2不溶于强酸和强碱,可用于制光导纤维
C.Cl2与SO2使品红溶液褪色的原理相同
D.常温下浓硫酸与铝不反应,可用铝槽车运输
参考答案:A、Fe与Zn形成原电池时Fe作正极被保护,所以镀锌铁的镀层破损后,镀层仍然对铁起保护作用,故A正确;
B、SiO2溶于强碱,SiO2晶体具有导光性,可用于制光导纤维,故B错误;
C、Cl2与水反应生成HClO的具有强氧化性,能使品红褪色,SO2没有强氧化性,使品红褪色发生的是非氧化性漂白,故C错误;
D、常温下浓硫酸与铝发生钝化,在铝的表面形成致密的氧化膜,阻止反应进一步发生,所以可用铝槽车运输,故D错误;
故选A.
本题解析:
本题难度:一般
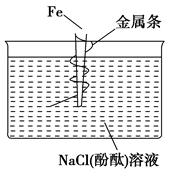
2、选择题 如图,缠上金属条的铁钉插在含有酚酞的NaCl溶液中,可以看到在金属条表面的溶液出现粉红色。该金属条可能是? ( )。
A.铜
B.镁
C.铝
D.锌
参考答案:A
本题解析:出现粉红色说明金属条附近产生了OH-,发生了吸氧腐蚀,金属条作正极,其活泼性比铁要差。
本题难度:简单
3、选择题 下列几种铁板,在镀层被破坏后,最耐腐蚀的是
[? ]
A.镀锌铁板
B.镀铜铁板
C.镀锡铁板
D.镀铅铁板
参考答案:A
本题解析:
本题难度:简单
4、选择题 如图所示,将两烧杯用导线如图相连,Pt、Mg、A1、C分别为四个电极,当闭合开关S后,以下表述正确的是

A.电流计指针不发生偏转
B.Al、Pt两电极有氢气生成
C.甲池pH减小,乙池pH不变
D.Mg、C两电极生成的气体在一定条件下可恰好完全反应
参考答案:D
本题解析:Al是负极,Mg是正极
负极:Al + 4OH-? -3e- =AlO2- +2H2O?
正极:2H2O + 2e- =H2↑ + 2OH-?
总反应式:2Al +2NaOH +H2O = 2NaAlO2+3H2 ↑
Pt是阴极,C是阳极
阳极:4OH- - 4e = 2H2O + O2↑
阴极:2H2O + 2e = H2↑ + 2OH-
总反应式:2H2O = 2H2↑ + O2↑
A、错误。左边是原电池,右边是电解池,电流表指针发生偏转。
B、错误。Al是负极,没有H2;Mg是正极,产生H2
C、错误。乙是电解水,水减少,NaOH浓度增大,pH增大
D、正确。正好产生H2和O2,且体积比是2:1,一定条件下可恰好完全反应。
故选D
点评:注意分析装置的特点,准确判断出原电池(1、有活动性不同的电极,2、有电解质溶液,3、有闭合回路,4、有自发的氧化还原反应。)与电解池(特点:有外接电源)。
本题难度:一般
5、简答题 (1)金属腐蚀会造成巨大的经济损失,钢铁在潮湿的空气中更容易被腐蚀,主要原因是钢铁里的铁和碳与钢铁表面吸附的一层水膜构成许多微小的______发生电化学腐蚀,该腐蚀中负极发生的电极反应式为______.
(2)某综合实践活动小组到自来水厂进行参观,了解到源水处理成自来水的工艺流程示意图如下:
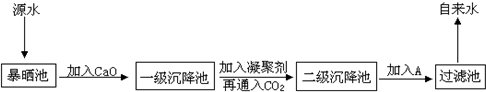
①源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入CaO,再通入CO2可以降低水中Ca2+、Mg2+等离子的浓度,从而将硬水转化为______水.
②该水厂加入的A物质常为氯气,其作用是______.
③加入凝聚剂可以除去其中的悬浮固体颗粒,以下物质中不能作为凝聚剂的是(填写编号)______.
A.KAl(SO4)2?12H2O B.Fe2(SO4)3 C.CuSO4 D.FeSO4?7H2O.
参考答案:(1)碳、铁和水构成原电池,所以能发生电化学腐蚀,该原电池中,铁作负极,碳作正极,负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,
故答案为:原电池,Fe-2e-=Fe2+;
(2)①钙镁离子较少或没有的水是软水,源水中含Ca2+、Mg2+、HCO3-、Cl-等,加入CaO,再通入CO2可以降低水中Ca2+、Mg2+等离子的浓度,从而将硬水转化为软水,故答案为:软;
②氯气和水反应生成盐酸和次氯酸,次氯酸具有强氧化性,所以能杀菌消毒,故答案为:杀菌消毒;
③凝聚剂能发生水解而生成胶体,胶体具有吸附性而净水,所以只要能水解生成胶体的就属于凝聚剂,明矾能水解生成氢氧化铝胶体、铁离子能水解生成氢氧化铁胶体、亚铁离子被氧化生成的铁离子易水解生成胶体,所以ABD能作凝聚剂,铜离子水解不能生成胶体,所以不能作凝聚剂,故选C.
本题解析:
本题难度:一般