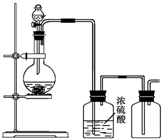
1、选择题 下列有关实验原理、方法和结论都正确的是( )
A.将SO2通入溴水中,溴水褪色,说明SO2具有漂白性
B.在滴有酚酞的Na2CO3溶液中逐滴加入BaCl2溶液,红色逐渐褪去,说明Na2CO3溶液中存在水解平衡
C.将CH3CH2Br与NaOH溶液混合加热,再滴加AgNO3溶液,可检验CH3CH2Br是否发生水解
D.向含有FeBr2的溶液中,加入适量氯水,再加入CCl4萃取、分液,可得到FeCl2溶液
参考答案:B
本题解析:
本题难度:简单
2、选择题 对下列实验的描述不正确的是
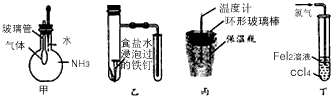
[? ]
A.图甲所示的实验:根据气球的变化证明氨气极易溶于水
B.图乙所示的实验:根据小试管中液面的变化判断铁钉发生 析氢腐蚀
C.图丙所示的实验:根据温度计读数的变化用稀盐酸和NaOH反应测定中和热
D.图丁所示的实验:根据试管中液体颜色的变化比较Cl2、 Fe3+、I2的氧化性
参考答案:B
本题解析:
本题难度:一般
3、简答题 某化学实验小组同学用图所示装置进行系列实验,以探究气体的性质(部分仪器已略去).
请回答: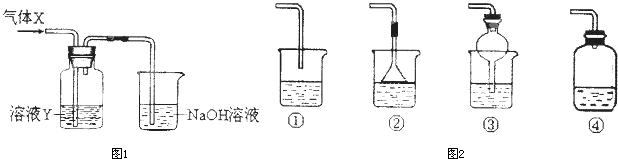
(1)若气体X为氯气,溶液Y为含有少量KSCN的FeCl2溶液,则可观察到溶液Y中的实验现象是______.写出NaOH溶液中发生反应的离子方程式:______.
(2)若溶液Y为品红溶液,气体X通过后,溶液褪色,取少量褪色后的溶液加热后恢复为红色,则气体X可能是______(填化学式).根据气体X的性质,上述实验装置应作一定的改进,则下列装置中,可用来替代其尾气吸收装置的是______(填序号).
参考答案:(1)氯气有强氧化性,能把亚铁离子氧化生成铁离子,离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,铁离子能和硫氰根离子反应生成红色的络合物,所以溶液呈红色,离子方程式为:Fe 3++3SCN-?Fe(SCN)3,氯气能和氢氧化钠反应生成氯化钠和次氯酸钠、水,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:溶液变为血红色;Cl2+2OH-=Cl-+ClO-+H2O;
(2)二氧化硫能使品红溶液褪色,且褪色后的溶液加热能恢复原色,所以该气体可能是SO2,二氧化硫能与氢氧化钠反应,①④装置尾气吸收不充分,②或③在导气管中都有相对较大的空间,这样既可以充分吸收,又可以防止倒吸现象的发生,
故答案为:SO2;②或③.
本题解析:
本题难度:简单
4、选择题 可用如图所示装置制取(必要时可加热)、净化、收集的气体是( )
A.亚硫酸钠固体与硫酸反应制二氧化硫
B.氯化铵与氢氧化钙固体反应制氨气
C.锌和稀硫酸反应制氢气
D.铜与稀硝酸反应制一氧化氮