1、推断题 已知五种元素的原子序数大小顺序为C>A>B>D>E,A、C同周期,B、C 同主族。A与B形成的离子化合物A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核 10电子的分子。请回答下列问题:
(1)写出位于同一主族的元素的名称:__________。
(2)用电子式表示离子化合物A2B的形成过程:______________________。
(3)写出下列物质的电子式:D元素形成的单质_______; E与B形成的化合物____; A、B、E形成的化合物________; D与E形成的共价化合物__________。
参考答案:(1)氧和硫,氢和钠
(2)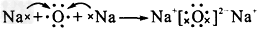 (3)
(3)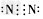 ;
;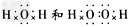 ;
;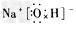 ;
;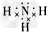
本题解析:
本题难度:一般
2、选择题 下列不能说明氯的非金属性比硫强的事实是( )
①HCl比H2S稳定?②HClO氧化性比H2SO4强?③HClO4酸性比H2SO4强?④Cl2能与H2S反应生成S?⑤Cl原子最外层有7个电子,S原子最外层有6个电子?⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS?⑦HCl酸性比H2S强.
A.②⑤⑦
B.①②⑦
C.②④
D.①③⑤
参考答案:①元素的非金属性越强,对应的氢化物越稳定,HCl比H2S稳定,可说明非金属性:Cl>S,故①正确;
②HClO氧化性比H2SO4强不能作为比较非金属性强弱的依据,故②错误;
③元素的非金属性越强,对应的最高价氧化物对应的水化物的酸性越强,HClO4酸性比H2SO4强,可说明非金属性:Cl>S,故③正确;
④Cl2能与H2S反应生成S,可说明氧化性:Cl2>S,单质的氧化性越强,对应元素的非金属性越强,故④正确;
⑤不能以最外层电子数的多少判断非金属性的强弱,例如O的最外层电子数为6,I的最外层电子数为7,但O的非金属性大于I,故⑤错误;
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS,可说明氧化性:Cl2>S,单质的氧化性越强,对应元素的非金属性越强,故⑥正确;
⑦比较非金属性的强弱,应根据对应的最高价氧化物对应的水化物的酸性比较,不能根据氢化物的酸性进行比较,例如HF的酸性比HCl弱,但非金属性F大于Cl,故⑦错误.
故选A.
本题解析:
本题难度:简单
3、选择题 下列描述违背化学原理的是
A.NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,说明结合H+的能力:AlO2->CO32-
B.将SO2通入酸性高锰钾溶液中,溶液褪色,不能说明SO2具有漂白性
C.高温时碳能置换出二氧化硅中的硅,说明还原性碳比硅强
D.亚硫酸是良好的还原剂,浓H2SO4是良好的氧化剂,但两者混合,却不发生氧化还原反应
参考答案:C
本题解析:NaHCO3溶液与NaAlO2溶液,反应中碳酸氢钠提供氢离子与偏铝酸根反应生成生成Al(OH)3,说明结合H+的能力:AlO2->CO32-,A正确;将SO2通入酸性高锰钾溶液中,溶液褪色,这是SO2具有还原性,B正确;还原性比较条件可以认为是:外界不加能量,如果外界加了能量,不能说明还原性大小,可以这么认为在高温下,碳和二氧化硅生成的一氧化碳是气体,根据化学平衡移动的原理,平衡是向正反应方向移动,即生成硅和一氧化碳,C错误;同种元素相邻价态间不发生氧化还原反应,D正确。
本题难度:简单
4、选择题 医学界通过用14C标记的C60发现了一种羧酸衍生物,在特定条件下,它可以通过断裂DNA来抑制艾滋病毒的繁殖。下列有关叙述中正确的是
[? ]
A.14C与12C的性质完全不同
B.14C与14N含有的中子数相同
C.14C60和12C60是碳元素的同素异形体
D.14C与12C、13C互为同位素
参考答案:D
本题解析:
本题难度:简单
5、选择题 下列关于物质的用途不正确的是
A.某些含铝或含铁的化合物可用作净水剂
B.氯气可用于自来水消毒
C.14C可用于考古断代
D.I2直接加入食盐中制加碘盐
参考答案:D
本题解析:考查物质的用途。
由于碘易挥发且有毒,考虑到品味、实用等因素,在碘盐中加入的一般为KIO3,其它物质的用途均正确,答案为D
本题难度:简单