| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点大全《弱电解质电离平衡》高频试题巩固(2017年最新版)(四)
参考答案:C 本题解析:根据方程式可知,要使指示剂显红色,则平衡应该向逆反应方向进行。所以根据方程式可知,增大氢离子浓度可以使平衡向逆反应方向进行,溶液显红色,答案选C。 本题难度:一般 2、选择题 在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65g锌粒,则下图所示比较符合客观事实的是 参考答案:C 本题解析: 本题难度:一般 3、选择题 下列物质中属于强电解质的是 |
参考答案:D
本题解析:强电解质是指在水溶液中或熔融状态下能完全电离的化合物,主要包括强酸强碱,大部分盐类、活泼金属氧化物等。NH3·H2O是弱碱,属于弱电解质,A错;Cl2是单质不属于电解质,B错,强电解质一定是属于纯净物,NaCl溶液是混合物,C错;NaHCO3属于盐类,是强电解质。
考点:强电解质的概念的理解。
本题难度:一般
4、选择题 pH="2" 的两弱酸HA.HB加水稀释后,溶液 pH随加水量的变化曲线如图所示。则下列叙述正确的是:(?)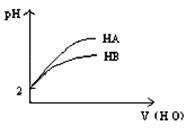
A.电离平衡常数HA > HB
B.等体积等pH的HA 和HB与等浓度的NaOH反应,HA消耗的NaOH多
C.等体积等pH的HA和HB 与等质量的Zn反应,HA反应速率大
D.若有等浓度的NaA.NaB,则碱性NaA>NaB
参考答案:A
本题解析:依据图示可知,两种酸都是弱酸,稀释过程中HA的PH变化比HB大,说明酸性HA大于HB;A.由于酸性HA>HB,故电离平衡常数HA>HB,A正确;B.酸性HA>HB,等PH时,HA的浓度一定小于HB的,由等体积,HA的物质的量一定小于HB的物质的量,HB消耗的氢氧化钠多,B错误;C.等体积等pH的HA和HB 与等质量的Zn反应,酸性HA>HB,浓度HA<HB,反应前溶液中氢离子浓度相等,反应中氢离子浓度HB的变化小,故与锌反应,开始时速率相等,之后HB的反应速率大,C错误;D.对应的酸的酸性越弱,水解程度越大,酸性HA>HB,故水解程度NaA<NaB,则碱性NaA<NaB,D错误;故选A.
本题难度:一般
5、选择题 PH=2的两种一元酸x和y,体积均为100ml,稀释过程中PH与溶液体积的关系如图所示,分别滴加 溶液(c=0.1
溶液(c=0.1 /L)至PH=7,消耗
/L)至PH=7,消耗 溶液的体积为Vx,Vy,则
溶液的体积为Vx,Vy,则
A.x为弱酸Vx<Vy
B.x为强酸Vx>Vy
C.y为强酸Vx>Vy
D.y为弱酸Vx<Vy
参考答案:D
本题解析:酸稀释过程中溶液的PH与稀释的关系为:
若为强酸,加水稀释至原溶液体积的10n倍,PH增加n个单位;
若为弱酸,加水稀释至原溶液体积的10n倍,PH增加的单位数少于n。
注:无论是强酸还是弱酸,无论稀释多少倍溶液PH均小于7。
由图分析,当加水稀释至原溶液体积的10倍时,X酸的PH由2增大为3,即X为一元强酸;而Y酸PH变化少于1介于2、3之间,所以Y酸为一元弱酸。
等体积等PH的一元强酸与一元弱酸,弱酸的物质的量过量,中和NaOH溶液,消耗的NaOH的物质的量更多。
综上所述,正确确答案为D。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《烃的衍生物.. | |