1、选择题 化学中常用图象直观地描述化学反应的进程或结果.下列图象描述正确的是( )
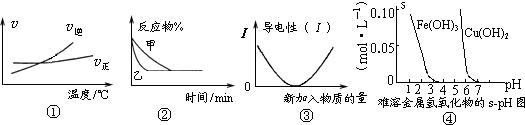
A.根据图①可判断可逆反应“A2(g)+3B2(g)?2AB3(g)”的△H>0
B.图②表示压强对可逆反应2A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右
参考答案:A、根据图象可知,温度升高,逆反应速率大于正反应速率,平衡向逆反应方向移动,则正反应为放热反应,△H<0,故A错误;
B、从图象可知,乙曲线斜率大,乙反应到达平衡用得时间少,则乙反应速率快,根据压强对反应速率的影响,压强越大反应速率越大,则乙曲线压强大,根据反应方程式可以看出,物质D为固体,则增大压强平衡向正反应方向移动,反应物的含量减小,而图中达到平衡时反应物的浓度在两种不同压强下相同,是不符合实际的,故B错误;
C、乙酸和氨水都为弱电解质,二者反应生成醋酸铵为强电解质,溶液中离子浓度增大,导电性增强,故C错误;
D、CuSO4溶液中加入适量CuO,发生:CuO+2H+═Cu2++H2O,溶液中H+浓度减小,易于Fe3+水解生成沉淀,当调节pH在4左右时,Fe3+全部水解生成沉淀而除去,故D正确.
故选D.
本题解析:
本题难度:一般
2、选择题 下列变化能加快反应速率,且反应物活化分子百分数增加的是
①?升高温度 ②使用证催化剂? ③增大压强? ④增加浓度
A ②④? ?B? ③④?C? ①② ?D ②③
?B? ③④?C? ①② ?D ②③
参考答案:C
本题解析:略
本题难度:简单
3、选择题 等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4,下列图中表示其产生H2总体积(V)与时间(t)的关系正确的是(? )

参考答案:A
本题解析:Zn能够与酸发生置换反应产生氢气,由于酸过量,所以反应放出氢气的多少按照Zn来确定。由于在a中同时加入少量CuSO4,Zn会发生反应:Zn+ CuSO4=ZnSO4+Cu.Zn减少,放出氢气的量也减少,但是由于Zn、Cu及硫酸形成了原电池,加快了反应速率,所以a比b反应速率快,但是量比b少些,选项的A。
本题难度:一般
4、选择题 对于可逆反应:aA(g)+bB(g) mC(g)+? nD(g);△H<0,下列说法正确的是
mC(g)+? nD(g);△H<0,下列说法正确的是
A.浓度改变平衡必移动
B.增大压强平衡必移动
C.升高温度平衡必移动
D.导入氦气平衡必移动
参考答案:C
本题解析:如果反应前后气体的体积不变,则通过改变压强改变浓度平衡不移动,因此选项A和B均不正确;正方应是放热反应,升高温度平衡一定向逆反应方向移动,C正确;如果容器的容积不变或反应前后气体的体积不变,则通入氦气平衡不移动,D不正确,答案选C。
本题难度:一般
5、填空题 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法

(1)已知:
2Cu(s)+1/2O2(g)=Cu2O(s);△H = -169kJ·mol-1
C(s)+1/2O2(g)=CO(g);△H = -110.5kJ·mol-1
Cu(s)+1/2O2(g)=CuO(s);△H = -157kJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+ C(s)= Cu2O(s)+CO(g);△H =_________kJ·mol-1
(2)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图所示:该电池的阳极反应式为___________________

(3)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为_________________________
(4)在相同的密闭容器中,用以上三种方法制得的Cu2O分别进行催化分解水的实验:
 ?△H>0 水蒸气的浓度随时间t变化如下表所示。
?△H>0 水蒸气的浓度随时间t变化如下表所示。

下列叙述正确的是_________(填字母)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率v(H2)=7×10-5 mol·L-1·min-1
C.实验②比实验①所用的催化剂催化效率高
参考答案:(1)+34.5
(2)2Cu-2e-+2OH-=Cu2O+H2O
(3)4Cu(OH)2 + N2H4 2Cu2O + N2 + 6H2O
2Cu2O + N2 + 6H2O
(4)BC
本题解析:
本题难度:一般