1、填空题 (14分)碘在科研与生活中有重要应用,某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I- 2SO42-+I2(慢) I2+2S2O32-
2SO42-+I2(慢) I2+2S2O32-  2I-+ S4O62-(快)
2I-+ S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-)∶n(S2O82-) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号
| 体积V/mL
|
K2S2O8溶液
| 水
| KI溶液
| Na2S2O3溶液
| 淀粉溶液
|
①
| 10.0
| 0.0
| 4.0
| 4.0
| 2.0
|
②
| 9.0
| 1.0
| 4.0
| 4.0
| 2.0
|
③
| 8.0
| Vx
| 4.0
| 4.0
| 2.0
|
表中Vx mL,理由是 。
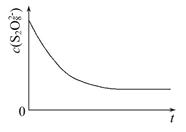
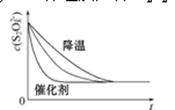
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)
(4)碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为:
2Li(s)+I2(s) 2LiI(s)ΔH
2LiI(s)ΔH
已知:①4Li(s)+O2(g) 2Li2O(s) ΔH1
2Li2O(s) ΔH1
②4LiI(s)+O2(g) 2I2(s)+2Li2O(s)ΔH2
2I2(s)+2Li2O(s)ΔH2
则电池反应的ΔH= ;碘电极作为该电池的 极。
参考答案:(1) Na2S2O3 <2
(2)2.0 保证反应物K2S2O8浓度改变,而其他的条件不变,才能达到实验目的;
(3)
(4)(△H1-△H2)/2 正
本题解析:(1)根据题目所给信息可知,若溶液中仍存在Na2S2O3,则碘单质将不会存在,溶液不会变蓝色,所以只有将Na2S2O3消耗完时,溶液才会由无色变为蓝色;根据化学方程式,Na2S2O3与K2S2O8完全反应,溶液中不存在碘单质时,Na2S2O3与K2S2O8的物质的量之比为2:1,所以为确保能观察到蓝色,则Na2S2O3的量少些,则n(S2O32-)∶n(S2O82-)<2;
(2)实验①、②中KI溶液、Na2S2O3溶液、淀粉溶液的体积不变,且K2S2O8溶液与水的总体积是10.0mL,该实验的目的是探究反应物浓度对化学反应速率的影响,为保证反应物K2S2O8浓度改变,而其他的条件不变,才能达到实验目的,所以在实验③中K2S2O8溶液与水的总体积必须也是10.0mL,则Vx=2.0mL;
(3)降低温度,该反应的反应速率减慢,而使用催化剂则会加快反应速率,反应完全时溶液中c(S2O82-)不变,所以对应的图像为 ;
;
(4)在2Li(s)+I2(s) 2LiI(s)中I元素的化合价降低,发生还原反应,所以碘作电池的正极,根据盖斯定律可知,ΔH=(①-②)/2=(△H1-△H2)/2.
2LiI(s)中I元素的化合价降低,发生还原反应,所以碘作电池的正极,根据盖斯定律可知,ΔH=(①-②)/2=(△H1-△H2)/2.
考点:考查对实验现象的分析,化学反应速率与图像的关系,盖斯定律的应用
本题难度:困难
2、选择题 在容积为2.0 L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,下列叙述不正确的是 (? )

A.从反应开始到第一次达到平衡时,A物质的平均反应速率为0.667mol/(L·min)
B.该反应的化学方程式为2D(s) 2A(g) + B(g)该反应的平衡常数表达式为K=c(A)2·c(B)
2A(g) + B(g)该反应的平衡常数表达式为K=c(A)2·c(B)
C.已知反应的△H>0,则第5分钟时图像呈现上述变化的原因可能是升高体系的温度
D.若在第7分钟时增加D的物质的量,则表示A的物质的量变化正确的是a曲线
参考答案:D
本题解析:从反应开始到第一次达到平衡时,A物质增加了0.4mol,则A的平均反应速率为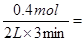 0.0667mol/(L·min),A正确;平衡时D减少了0.4mol,A增加了0.4mol,B增加了0.2mol,即DAB的变化量之比是2:2:1,所以该反应的化学方程式为2D(s)
0.0667mol/(L·min),A正确;平衡时D减少了0.4mol,A增加了0.4mol,B增加了0.2mol,即DAB的变化量之比是2:2:1,所以该反应的化学方程式为2D(s) 2A(g) + B(g),该反应的平衡常数表达式为K=c(A)2·c(B),B正确;如果正反应是吸热反应,则升高温度平衡向正反应方向移动,因此符合图中变化趋势,C正确;D是固体,改变固体的质量,平衡不移动,则表示A的物质的量变化正确的是b曲线,D不正确,答案选D。
2A(g) + B(g),该反应的平衡常数表达式为K=c(A)2·c(B),B正确;如果正反应是吸热反应,则升高温度平衡向正反应方向移动,因此符合图中变化趋势,C正确;D是固体,改变固体的质量,平衡不移动,则表示A的物质的量变化正确的是b曲线,D不正确,答案选D。
本题难度:一般
3、选择题 对于100mL 1mol/L硫酸与足量的铝片反应,采取下列措施能使反应速率加快且H2的产量不变的是:①升高温度;②改用100mL 18mol/L硫酸;③改用100mL 2mol/L硝酸;④用足量铝粉代替铝片;⑤滴入少量CuSO4溶液
A.①③⑤
B.①④⑤
C.②③⑤
D.①②④
参考答案:B
本题解析:考查外界条件对反应速率的影响。升高温度能加快反应速率,①正确。浓硫酸和铝钝化,不能生成氢气,②不正确。硝酸和铝反应生成的气体是NO,而不是氢气,③不正确。④是增大反应物的接触面积,正确。铝能把硫酸铜置换出铜,从而构成原电池,铝是负极,加快反应速率,⑤正确,所以答案选B。
本题难度:简单
4、选择题 在N2 + 3H2 ?2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6
?2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6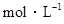 ?,在此时间内用NH3表示的反应速率为0.30
?,在此时间内用NH3表示的反应速率为0.30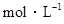 ·S-1。则此一段时间是:(?)
·S-1。则此一段时间是:(?)
A.1秒
B.2秒
C.0.44秒
D.1.33秒
参考答案:B
本题解析:化学反应速率=△C/△t,所以0.6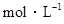 /△t =0.30
/△t =0.30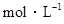 ·S-1,则△t=2s。
·S-1,则△t=2s。
点评:本题计算量不大,只需要简单利用化学反应速率的公式,带入计算。这是学生需要掌握的基本知识。
本题难度:简单
5、选择题 一定温度下,向一个容积为2L的真空密闭容器中(事先装入催化剂)通入1mol N2和3mol H2,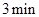 后测得密闭容器内的压强是起始时的0.9倍,在此时间内
后测得密闭容器内的压强是起始时的0.9倍,在此时间内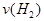 是
是
A.
B.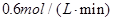
C.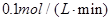
D.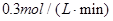
参考答案:C
本题解析:? N2? +? 3H2?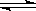 ?2NH3
?2NH3
起始? 1mol? 3mol? 0
反应? xmol? 3xmol? 2xmol
3min (1-x)mol? (3-3x)mol? 2xmol
因为压强是起始时的0.9倍所以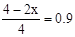 ,所以x=0.2mol,v(H2)=
,所以x=0.2mol,v(H2)= 。答案选C。
。答案选C。
点评:本题非常基础,主要考查三段式与反应速率的计算。
本题难度:简单