1、填空题 一包粉末可能含有K+、Fe3+、Al3+、Cl-、SO42-、CO32-中的若干种,现进行以下实验:
(1)取少量固体,加入稀硝酸搅拌,固体全部溶解,没有气体放出;
(2)向(1)所得溶液中加入一定量Ba(OH)2溶液,生成有色沉淀,过滤后在滤液中加入稀硝酸酸化,然后滴入AgNO3溶液,有白色沉淀生成;
(3)取(2)中的有色沉淀加入足量的稀盐酸后,沉淀全部溶解;
(4)重新取少量固体加入适量蒸馏水搅拌后,固体全部溶解,得到澄清溶液;
(5)向(4)所得的溶液中加入氨水使溶液呈碱性,有沉淀生成,过滤。往得到的沉淀中加入过量的NaOH溶液,沉淀减少。
根据上述实验,这包粉末中一定不含有的离子是 _____,肯定含有的离子是 _____,不能确定是否含有的离子是 _____,可通过 _____(填实验方法)来进一步确定该离子。
参考答案:
CO32-、SO42-;?Cl-、Al3+、Fe3+;?K+?;?焰色反应
本题解析:
本题难度:一般
2、选择题 如下表除去杂质应选用的试剂或操作方法,正确的是
A.A
B.B
C.C
D.D
参考答案:B
本题解析:分析:根据原物质和杂质的性质选择适当的除杂剂和分离方法,所谓除杂(提纯),是指除去杂质,同时被提纯物质不得改变.除杂质题至少要满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应;②反应后不能引入新的杂质.
解答:A.KOH溶液能与FeCl3溶液反应生成氢氧化铁沉淀和氯化钾,引入新的杂质,不符合除杂原则,故A错误;
B.FeCl3酸性溶液中少量的FeCl2在加入稍过量双氧水后会被氧化为三氯化铁和水,双氧水是绿色氧化剂,故B正确;
C.通过灼热的Cu网后,氧气可以和金属铜发生反应生成氧化铜,并且一氧化碳会和氧气反应生成二氧化碳,这样在一氧化碳中会引入二氧化碳,不符合除杂的原则,故C错误;
D.碳酸氢钠分解生成的是碳酸钠、水以及二氧化碳,这样会在碳酸钾中引入杂质碳酸钠,故D错误.
故选B.
点评:本题考查物质的分离与除杂,难度不大,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键.
本题难度:一般
3、选择题 某无色溶液中只可能含有①Na+ ②Ba2+、③Cl-、④Br-、⑤SO32-、⑥SO42-离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下
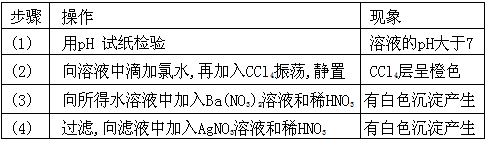
下列结论正确的是
[? ]
A.肯定含有的离子是①④⑤
B.肯定没有的离子是②⑤
C.可能含有的离子是①⑥
D.不能确定的离子是①③⑥
参考答案:A
本题解析:
本题难度:一般
4、选择题 向硫酸亚铁溶液中滴加无色KSCN,溶液呈现的颜色是
[? ]
A.绿色
B.无色
C.红色
D.黄色
参考答案:A
本题解析:
本题难度:一般
5、选择题 将氯化钠、三氯化铝、氯化亚铁、氯化铁四种溶液,通过一步实验就能加以区别的试剂是
A.KSCN
B.NaOH
C.BaCl2
D.HCl
参考答案:B
本题解析:分析:四种物质与所选物质反应,发生的现象应各有不同,根据四种物质与所给选项中的四种物质反应的现象逐一分析,即可正确选择.
解答:A、硫氰化钾只能和氯化铁之间发生络合反应,使溶液变红色,而和其他物质间不反应,故A错误;
B、氯化钠和氢氧化钠混合无现象发生,不反应;氯化铝中逐滴加入氢氧化钠,先出现白色沉淀然后沉淀会消失;氯化亚铁和氢氧化钠反应先出现白色沉淀然后变为灰绿色最后变为红褐色,氯化铁和氢氧化钠反应生成红褐色沉淀;氯化镁和氢氧化钠反应生成白色沉淀,现象各不相同,故B正确;
C、氯化钡和选项中的物质间均不反应,无现象,故C错误;
D、盐酸和选项中的物质间均不反应,无现象,故D错误.
故选B.
点评:本题考查物质的鉴别,较好的考查同学们的综合分析能力,不但要求同学们具备有关化合物的基础知识,而且要有实验操作的经历和分析、解决化学实验问题的能力.解题时需要认真分析题目给出的条件,联系实际,逐一分析推断.
本题难度:困难