1、填空题 (3分)在标准状况下有:① 0.3mol氨气?②6.02×1022个H2O分子? ③7.3gHCl?④ 0.2molCH4。请将序号填在后面横线上,
体积最大的是?;密度最大的是?;质量最大的是?。
参考答案:①;?②;?③?(各1分)
本题解析:略
本题难度:简单
2、实验题 (12分)实验室需要配制0.1 mol/L NaOH溶液450 mL,回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称)
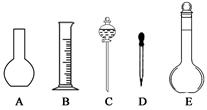
(2)下列操作中,容量瓶所具备的功能有 (填序号)。
A.贮存溶液
B.配制一定体积准确浓度的标准溶液
C.测量容量瓶规格以下的任意体积的液体
D.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为 g;
(4)取用任意体积的所配0.1 mol/L NaOH溶液时,下列物理量中不随所取体积的多少而变化的是(填字母) ;
A.溶液中NaOH的物质的量 B.溶液的浓度
C.溶液中Na+的数目 D.溶液的密度
(5)将所配制的NaOH溶液进行测定,发现浓度大于0.1 mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母) 。
A.烧杯未进行洗涤
B.配制前,容量瓶中有少量蒸馏水
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容;
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
参考答案:(12分)
(1)A C ; 烧杯 玻璃棒 (2)B (3)2.0 g (4)B D (5) C E
本题解析:(1)没有450mL容量瓶,选择500mL容量瓶,操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,用玻璃棒搅拌,加速溶解,恢复室温后转移到500mL容量瓶中,并用玻璃棒引流,洗涤2-3次,并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,所以需要的仪器有托盘天平、药匙、烧杯、500ml的容量瓶、胶头滴管,所以如图所示的仪器中配制溶液肯定不需要的AC,配制上述溶液还需用到的玻璃仪器是烧杯和玻璃棒。
(2)容量瓶是用来配制一定体积准确浓度的标准溶液的玻璃仪器,它不能贮存溶液 ,也不能测量容量瓶规格以下的任意体积的液体,不能用来加热溶解固体溶质,选B。
(3)需氢氧化钠的质量为m=0.5L×0.1mol?L-1×40g/mol=2.0g.
(4)A.溶液中NaOH的物质的量n=CV,与溶液的体积有关,错误;B.溶液的浓度与所量取的体积无关,正确;C.溶液中Na+的数目N=CVNA,所以与溶液的体积有关,错误;D.溶液的密度与所量取溶液的体积无关,正确;选BD.
(5)A.烧杯未进行洗涤,导致溶质减少,所配溶液浓度偏低,B.配制前,容量瓶中有少量蒸馏水,对测定结果无影响,C.NaOH在烧杯中溶解后,根据热胀冷缩原理,未冷却就立即转移到容量瓶中,并进行定容,导致水加少了,所配溶液浓度偏高,D.往容量瓶转移时,有少量液体溅出,导致溶质减少,所配溶液浓度偏低,E.在容量瓶中定容时俯视容量瓶刻度线,导致水加少了,所配溶液浓度偏高,F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线,导致水量增加,所配溶液浓度偏低。选CE。
考点:考查一定物质的量浓度溶液的配制。
本题难度:困难
3、简答题 已知:Pb的化合价只有+2、+4,且+4价的Pb具有强氧化性,能氧化浓HCl生成Cl2;PbO2不稳定,随温度升高按下列顺序逐步分PbO2→Pb2O3→Pb3O4→PbO.现将a?mol?PbO2加热分解,收集产生的O2;向加热后所得固体中加入足量的浓盐酸,收集产生的Cl2.加热反应后所得固体中,Pb2+占Pb元素的物质的量分数为x;两步反应中收集的O2和Cl2的物质的量之和为y?mol.
试回答下列问题:
(1)试写出Pb2O3与浓盐酸反应的化学方程式______.
(2)用含X与a的表达式表示产生的O2、Cl2的物质的量n(O2)=______?n(Cl2)=______
(3)写出y与a、x的函数关系式.______
(4)若两步反应中O2和Cl2的物质的量之比为5:3,则剩余固体中含有的物质为______;其物质的量之比为______.
参考答案:(1)Pb2O3中Pb的化合价只有+3,且+3价的Pb具有氧化性,能氧化浓盐酸生成C12,本身被还原成+2价Pb,生成PbC12,根据元素守恒得反应物与生成物并根据化合价升降法配平该氧化还原反应,得出Pb2O3+6HCl(浓)═2PbCl2+Cl2↑+3H2O,故答案为:Pb2O3+6HCl(浓)═2PbCl2+Cl2↑+3H2O;
(2)根据题意:1mol?PbO2分解所得混合物中n(Pb2+)=x?mol、n(Pb4+)=(1-x)?mol.在反应过程中1mol?PbO2中+4价的Pb具有强氧化性作氧化剂,
+4价的Pb最终全部降低为+2价,根据得失电子守恒:先加热分解生成O2,得n(O2)=2x4a=x2amol;
后再与足量的浓盐酸反应生成Cl2,得n(Cl2)=a×(1-x)×22=(1-x)a?mol,
故答案为:ax2mol;a(1-x)mol;
(3)y=n(O2)+n(Cl2)=x2mol+(1-x)a?mol=(1-x2)amol,
故答案为:y=(1-x2)amol;
(4)若两步反应中O2和Cl2的物质的量之比为5:3,根据上述分析:n(O2)=a×x2=mol,n(Cl2)=a(1-x)mol,即? x2:(1-x)=5:3,
解得:x═1013,则剩余固体中含pb2+的物质的量分数为1013,含pb4+的物质的量分数为 313,即n(pb2+):n(pb4+)═10:3,
由题意,PbO2不稳定逐步分解顺序:PbO2→Pb2O3→Pb3O4→PbO.因为Pb的化合价只有+2、+4,所以Pb2O3可表示为
PbO?PbO2,Pb3O4可表示为2PbO?PbO2,各氧化物中n(pb2+):n(pb4+)的比值关系为:
PbO2中,n(pb2+):n(pb4+)═0:1
Pb2O3中,n(pb2+):n(pb4+)═1:1
Pb3O4中,n(pb2+):n(pb4+)═2:1
PbO中,n(pb2+):n(pb4+)═1:0
根据剩余固体中n(pb2+):n(pb4+)═10:3,介于3:1和4:1之间,所以此时剩余固体包括Pb3O4、PbO两种物质,.
设剩余固体中Pb3O4物质的量为a、PbO物质的量为b,
得n(pb2+)═2a+b,n(pb4+)═a,
则(2a+b):a═10:3
解得a:b═3:4,即Pb3O4:PbO=3:4,
故答案为:Pb3O4、PbO;3:4.
本题解析:
本题难度:一般
4、选择题 下列溶液中,氯离子浓度最大的是( )
A.10mL0.15mol?L-1的AlCl3溶液
B.150mL0.2mol?L-1的MgCl2溶液
C.200mL0.1mol?L-1的HCl溶液
D.100mL0.3mol?L-1的NaCl溶液
参考答案:A、10mL 0.15 mol?L-1的AlCl3溶液中Cl-浓度为0.15mol/L×3=0.45mol/L;
B、150mL 0.2mol/L MgCl2溶液中Cl-浓度为0.2mol/L×2=0.4mol/L;
C、200mL 0.1mol/L HCl溶液中Cl-浓度为0.1mol/L×1=0.1mol/L;
D、100mL 0.3mol/L NaCl溶液中Cl-浓度为0.3mol/L×1=0.3mol/L;
故选A.
本题解析:
本题难度:一般
5、选择题 质量相等的下列物质中,含分子数最多的是 ( )
A.CH4
B.O2
C.NH3
D.CO