1、填空题 微电解技术具有处理效果显著、投资少、运行费用低等优点。铝碳微电解处理就是利用铝-碳颗粒之间形成了无数个细微原电池,这些细微电池在酸性溶液中发生电化学反应。溶液中溶解一定量的氧可以增大铝的腐蚀效率,因此可以通过曝气来强化处理效果。实验装置如图:

(1)实验前,将铝屑在5%NaOH碱洗10分钟,目的是①?,②?。
(2)曝气条件下,在酸性溶液中,该装置中发生的电极反应为:铝极?,碳极?。
(3)通过铝碳微电解法可以对含镍电镀废水进行处理,某化学研究小组研究了铝碳比、反应停留时间对处理效果的影响,结果如下:
 ?
?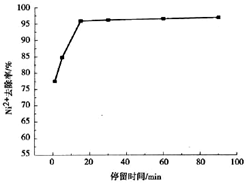
通过分析,确定最佳工艺的铝碳比为?,反应停留时间是?。
参考答案:
(1)①除去铝屑表面的油污(1分)②除去表面的氧化物(1分)(不分前后)
(2)4Al-12e-=4Al3+(1分) 3O2+12H++12e-=6H2O(1分)(前后电子未守恒也给分)
(3)1:1.5(1分)? 15min(答成14min~16min都给分)(1分)
本题解析:(1)一般在金属等溶解时先用碱洗促进金属表面的油污水解而除去,氧化铝为两性与碱反应而除去氧化膜;(2)酸性溶液中铝失去电子生成铝离子;溶液中含有较多氧气,在碳极得到电子发生还原反应;(3)图一显示铝碳比为1:1.5时镍离子去除率最高;图二显示15min左右时镍离子去除率不再发生明显变化,反应停留时间是15分钟左右。
本题难度:一般
2、选择题 钢铁发生吸氧腐蚀时,正极上发生的反应是
A.2Fe-4e— =2Fe2+
B.2Fe2++4e— =2Fe
C.2H2O+O2+4e—=4OH—
D.Fe3++e—=Fe2+
参考答案:C
本题解析:略
本题难度:一般
3、选择题 下列叙述正确的是( )
①锌跟稀硫酸反应制取氢气,加入少量硫酸铜溶液能加快反应速率;
②镀层破损后,白铁(镀锌铁)比马口铁(镀锡铁)更易腐蚀;
③能自发进行的氧化还原反应,都可以设计原电池的装置?
④铅蓄电池在放电过程中,负极质量减小,正极质量增加?
⑤可用于电动汽车的铝-空气燃料电池,以NaOH溶液为电解液时,负极反应为:
Al+3OH--3e-=Al(OH)3↓
⑥实验室中用稀HNO3溶液与Cu反应制取NO气体反应很慢,加一块石墨使之与Cu接触后反应加快
A.②④⑤
B.①③⑥
C.①③④
D.②⑤⑥
参考答案:B
本题解析:①构成原电池,加快反应速率。白铁(镀锌铁)中锌是负极,铁是正极,被保护,而马口铁(镀锡铁)中铁负极,被腐蚀,②错误。③正确。蓄电池在正负极上的都生成硫酸铅,质量均增加,④不正确。氢氧化铝是两性氢氧化物能溶于强碱,负极产物是AlO2-,⑤不正确。加入石墨后即构成原电池,铜是负极,加快反应速率,正确。所以答案是B。
本题难度:一般
4、选择题 铁片与下列金属用导线连接后,插入稀盐酸中,铁受到保护,该金属是( )
A.Zn
B.Cu
C.Ag
D.Sn
参考答案:铁片、某种金属、和盐酸能构成原电池,铁受到保护,则某种金属作负极,铁作正极,根据一般的原电池中,较活泼的金属作负极,较不活泼的金属作正极,所以某种金属的活泼性应该大于铁的活泼性,铜、银、Sn的活泼性都小于铁,只有Zn的活泼性大于铁,所以该金属是锌,故选A.
本题解析:
本题难度:一般
5、选择题 下列叙述正确的是(?)
A.铁与稀H2SO4反应时,加入少量CuSO4溶液,可使反应速率加快
B.构成原电池的正极和负极必须是两种不同的金属
C.在铁片上镀铜时,金属铜作阴极
D.用惰性电极电解CuSO4溶液,溶液的pH不变
参考答案:A
本题解析:铁能置换出铜,从而构成原电池,铁是负极,加快反应速率,选项A正确;选项B不正确,也可以是金属和非金属;电镀时,待镀金属作阴极,镀层金属作阳极,含有镀层金属离子的溶液作电镀液,因此选项C不正确;;惰性电极电解硫酸铜析出的是铜和氧气,同时还生成硫酸,pH降低,选项D不正确,答案选A。
本题难度:一般